

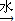 Al(OH)3+H2S+KCl,可知A、B、C、D四种元素为Al、S、Cl、K,A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S.
Al(OH)3+H2S+KCl,可知A、B、C、D四种元素为Al、S、Cl、K,A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S.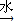 Al(OH)3+H2S+KCl,可知A、B、C、D四种元素为Al、S、Cl、K,A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S,
Al(OH)3+H2S+KCl,可知A、B、C、D四种元素为Al、S、Cl、K,A、B、C、D四种元素原子的核电荷数依次增大,故A为Al,B为S,C为Cl,D为K,由A+C→E可知,E为AlCl3,由B+D→F可知,F为K2S, ;
; ;
;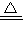 Al2O3+2H2O,最终得到的固体为Al2O3;
Al2O3+2H2O,最终得到的固体为Al2O3; 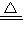 Al2O3+2H2O;
Al2O3+2H2O; =0.18mol/(L?min),速率之比等于化学计量数之比,故v(O2 )=
=0.18mol/(L?min),速率之比等于化学计量数之比,故v(O2 )= v(SO3)=
v(SO3)= ×0.18mol/(L?min)=0.09mol/(L?min);
×0.18mol/(L?min)=0.09mol/(L?min);

科目:高中化学 来源: 题型:




| ||
| ||
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013

A. 4x
B. 4x+6
C. 4x+10
D. 4x+14
查看答案和解析>>
科目:高中化学 来源: 题型:013
原子序数为J的元素声周期表中位于A、B、C、D四种元素的中间,A、B、C、D四种元的是(镧系、锕系,零族元素除外)…( )

A. 4x
B. 4x+6
C. 4x+10
D. 4x+14
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为:  ,B、C可形成离子化合物
,B、C可形成离子化合物![]() ,据此填空:
,据此填空:
![]() (1)A的元素名称为 ,其气态氧化物的化学式为 。
(1)A的元素名称为 ,其气态氧化物的化学式为 。
![]() (2)A、B、C、D四种元索的原予,半径由小到大的顺序为 。
(2)A、B、C、D四种元索的原予,半径由小到大的顺序为 。
![]() (3)B和C最高价氧化物的水化物化学式分别为 和 。
(3)B和C最高价氧化物的水化物化学式分别为 和 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为:  ,B、C可形成离子化合物
,B、C可形成离子化合物![]() ,据此填空:
,据此填空:
(1)A的元素名称为 ,其气态氧化物的化学式为 。
(2)A、B、C、D四种元索的原予,半径由小到大的顺序为 。
(3)B和C最高价氧化物的水化物化学式分别为 和 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com