
| A. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓正确 | |
| B. | 向碳酸镁中加入稀盐酸:CO32-+2H+═CO2↑+H2O 错误,碳酸镁不应该写成离子形式 | |
| C. | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓正确 | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++2OH-+2H++SO42-═CaSO4↓+2H2O 错误,反应物和产物的配比不正确 |
分析 A.石灰乳中氢氧化钙应保留化学式;
B.碳酸镁为沉淀,应保留化学式;
C.漏掉铵根离子与氢氧根离子的反应;
D.氢氧化钙溶液与等物质的量的稀硫酸反应生成硫酸钙和水.
解答 解:A.石灰乳与Na2CO3溶液混合,离子方程式:Ca(OH)2+CO32-═CaCO3↓+2OH-,故A错误;
B.向碳酸镁中加入稀盐酸:MgCO3+2H+═CO2↑+H2O+Mg2+,碳酸镁为沉淀,应保留化学式,评价正确,故B正确;
C.向硫酸铵溶液中加入氢氧化钡溶液,离子方程式:2NH4++2OH-+Ba2++SO42-═BaSO4↓+2NH3•H2O,故C错误;
D.氢氧化钙溶液与等物质的量的稀硫酸反应生成硫酸钙和水,离子方程式:Ca2++2OH-+2H++SO42-═CaSO4↓+2H2O,所以评价错误,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4和NaOH反应的中和热是HCl和NaOH反应的中和热的两倍 | |
| B. | CO的标准燃烧热是△H=-283.0KJ/mol,则反应2CO2(g)═2CO(g)+O2(g)的△H=+566.0KJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 甲烷完全燃烧生成液态水和二氧化碳气体所放出的热量是甲烷的标准燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离、提纯NaCl与KNO3混合物中的KNO3 | |
| B. | 将NaCl溶液蒸发、结晶转变为NaCl固体 | |
| C. | 用四氯化碳萃取溴水中的溴 | |
| D. | 实验室利用KMnO4与浓盐酸反应制备氯气(Cl2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将少量二氧化硫气体通入次氯酸钠溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| C. | 4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| D. | FeBr2溶液中通入过量Cl2:2Fe2++2Br-+Cl2-═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
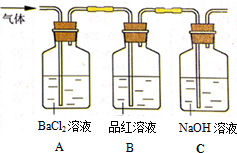 工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑
工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com