
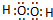 ,W第一步电离方程式为H2O2?H++HO2-.
,W第一步电离方程式为H2O2?H++HO2-.分析 六种主族元素A、B、C、D、X、Y,其原子序数依次增大,均小于54;常温下A2B呈液态,是食物中主要营养物质,A2B是H2O,故A为氢元素,B为氧元素;高纯C单质具有良好的半导体性能,C为Si元素;D、X、Y原子核外最外层电子数均为7,处于第ⅦA族,D与氧元素不相邻,且Y的原子序数小于54,故D为Cl元素、X为Br元素、Y为I元素;过渡元素Z与B可形成多种化合物,其中红棕色粉末Z2B3常用作外墙涂料,Z为Fe元素,据此解答.
解答 解:六种主族元素A、B、C、D、X、Y,其原子序数依次增大,均小于54;常温下A2B呈液态,是食物中主要营养物质,A2B是H2O,故A为氢元素,B为氧元素;高纯C单质具有良好的半导体性能,C为Si元素;D、X、Y原子核外最外层电子数均为7,处于第ⅦA族,D与氧元素不相邻,且Y的原子序数小于54,故D为Cl元素、X为Br元素、Y为I元素;过渡元素Z与B可形成多种化合物,其中红棕色粉末Z2B3常用作外墙涂料,Z为Fe元素,
(1)将Cl2水溶液滴入浅绿色的FeCl2溶液中发生反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+,
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;
①学生甲认为X2和Y2都可能将Z2+氧化为Z3+,他推理的依据应是:Cl、Br、I均是第ⅦA族元素,其单质的氧化性均较强,
故答案为:Cl、Br、I均是第ⅦA族元素,其单质的氧化性均较强;
②而学生乙认为X2和Y2都不能将Z2+氧化为Z3+;学生丙认为X2能将氧化Z2+为Z3+,而Y2不能.学生乙、丙推理的依据是:
Cl、Br、I均是第ⅦA族元素,自上而下非金属性减弱,其单质的氧化性减弱,
故答案为:Cl、Br、I均是第ⅦA族元素,自上而下非金属性减弱,其单质的氧化性减弱;
(2)A与B可形成既含极性键又含非极性键的化合物W.W的水溶液呈弱酸性,常用作无公害的消毒杀菌剂等,W为H2O2,
①H2O2中氢原子与氧原子之间形成一对共用电子对,氧原子之间形成1对共用电子对,故电子式为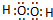 ,其水溶液呈弱酸性,为弱电解质,电离出H+、HO2-,故W第一步电离方程式为H2O2?H++HO2-,
,其水溶液呈弱酸性,为弱电解质,电离出H+、HO2-,故W第一步电离方程式为H2O2?H++HO2-,
故答案为: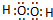 ;H2O2?H++HO2-;
;H2O2?H++HO2-;
②如果配制W溶液的水中含有Fe3+,Fe3+对H2O2的分解其催化剂作用,发生反应2H2O2$\frac{\underline{\;Fe_{3}+\;}}{\;}$2H2O+O2↑,会削弱H2O2的消毒杀菌能力,甚至会完全失去杀菌作用,
故答案为:2H2O2$\frac{\underline{\;Fe_{3}+\;}}{\;}$2H2O+O2↑;
(3)①锗再硅元素的下一周期,二者原子序数形成18,故锗的原子序数为14+18=32,故答案为:32;
②同主族自上而下金属性增强,金属性越强,它们+4价氢氧化物的碱性越强,故碱性由强到弱顺序为:Pb(OH)4>Sn(OH)4>Ge(OH)4,
故答案为:Pb(OH)4>Sn(OH)4>Ge(OH)4.
点评 本题考查位置结构性质关系、元素周期律等,难度中等,推断元素是解题的关键,是对学生综合能力的考查,需要学生具有扎实的基础知识与运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | A+B═C+D | B. | 2A+B═2C+D | C. | A+B═2C+D | D. | 2A+B═C+2D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
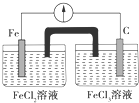
| A. | Fe是负极,C是正极 | B. | 负极反应式:Fe-3e-═Fe3+ | ||
| C. | 内电路中阴离子移向FeCl2溶液 | D. | 电流由石墨电极流向Fe电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3═Na++H++CO32- | B. | Fe2(SO4)3═Fe3++SO42- | ||
| C. | KClO3═K++Cl-+3O2- | D. | H2SO4═2H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | SO2(mol) | O2(mol) | N(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
| A. | 在上述条件下反应生成1molSO3气体放热98.5 kJ | |
| B. | Q1=2Q2=2Q3=197 kJ | |
| C. | 上述条件下1mol O2参加反应放出的热量为197 kJ/mol | |
| D. | Q2<Q3<Q1<197kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
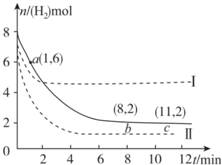 T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )
T℃时,6 mol CO2和 8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物质的量随时间的变化如图中实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=1 mol•L-1•min-1 | |
| B. | 若曲线Ⅰ对应的条件改变是升温,则该反应△H>0 | |
| C. | 曲线Ⅱ对应的条件改变是减少压强 | |
| D. | T℃时,该反应的化学平衡常数为0.125 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com