
在20℃,5.05×105Pa条件下,密闭容器中进行反应2A(g)+xB(g)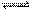 4C(g),达平衡时c(A)=1.00mol•L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol•L-1,则下列说法正确的是 ( )
4C(g),达平衡时c(A)=1.00mol•L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol•L-1,则下列说法正确的是 ( )
A.系数x >2
B.若增大该体系的压强,平衡向左移动,化学平衡常数变小
C.若增大该体系的压强,平衡向右移动,化学平衡常数不变
D.该反应的化学平衡常数表达式是K=
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列物质能使干燥的蓝色石蕊试纸变红又褪色的是
①氯气 ②液氯 ③新制氯水 ④氯气的酒精溶液 ⑤盐酸 ⑥过量盐酸酸化过的漂白粉溶液
A.①②③ B.①②③⑥
C.③⑥ D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
关于苯的下列说法正确的是( )
A.苯的分子是环状结构,其性质跟烷烃相似
B.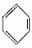 表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟烯烃相同
表示苯的分子结构,其中含有碳碳双键,因此苯的性质跟烯烃相同
C.苯的分子式是C6H6,分子中的C原子远没有饱和,因此能使溴水褪色
D.苯环上的碳碳键是介于碳碳单键和碳碳双键之间的键
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同且恒容的 密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密 闭容器乙中通入0.5 mol N2和1.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是( )
A.Q1=2Q2=92.4 B.92.4 >Ql>2Q2 C.92.4=Q1>2Q2 D.92.4 >Q1=2Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能用勒沙特列原理解释的是( )
①由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 ②实验室中用氯化钠固体与浓硫酸共热制取氯 化氢气体 ③用排饱和食盐水法收集Cl2 ④温度控制在500℃有利于合成氨反应 ⑤工业制取金属钾Na(l)+ KCl(l) 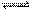 NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
A.②③⑤ B.①③⑤ C.①②③④⑤ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密
闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s) + 3H2 (g)  W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___________________________。
(2)某温度下反应达平衡时,H2与水蒸气的体积比为3:5,则H2的平衡转化率__________________。
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
500℃时,固体物质的主要成分为 ;
第二阶段反应的化学方程式为 ;
假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为________________。
钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作 原理为:W (s) +2I2 (g) 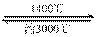 WI4 (g)。下列说法正确的有________________
WI4 (g)。下列说法正确的有________________
a.灯管内的I2可循环使用
b.WI4在灯管壁上分解,使灯管的寿命延长
c.WI4在灯丝上分解,产生的W又沉积在灯丝上
d.接通电源后,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.05 mol·L-1Fe2(SO4)3溶液中含Fe3+数目为0.1 NA
B.标准状况下,22.4L甲苯中含C—H数目为8 NA
C.常温、常压下,1.6g O2和O3混合物中,氧原子的数目为0.1NA
D.0.1mol Na2O2与足量CO2反应时,转移的电子数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl是从海水中提取出来的一种重要物质,除食用外,它还是一种工业原料,下列以NaCl为原料的产品(或物质)是
①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸
A.全部 B.只有①②③④
C.只有①②③⑤ D.只有①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4,M元素原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题:
(1)写出Z与N形成的化合物的电子式_______________________________________。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式______________________________________________________________(分解反应)。
(3)下表表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________________________________。
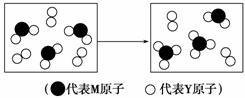
(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1∶1∶1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为________,B的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com