
| A. | CaO | B. | Al(OH)3 | C. | NaHCO3 | D. | MgCO3 |
分析 胃药的成分是能跟盐酸起反应的物质,以减少胃中盐酸的含量,反应生成物应无毒,由于是胃溃疡较重,不宜生成气体,否则会造成胃穿孔,加重病情.碱性强有腐蚀性的,不宜做胃药.
解答 解:A.CaO具有很强的腐蚀性,不宜做胃药,故A错误;
B.Al(OH)3是不溶性的碱,能中和胃酸降低胃中的酸度,故B正确;
C.NaHCO3是一种盐,水溶液呈微碱性,与盐酸反应生成二氧化碳气体,会造成胃穿孔,加重病情,故C错误.
D.MgCO3是不溶于水的固体盐,能溶于盐酸,降低胃中的酸度,但生成二氧化碳气体,会造成胃穿孔,加重病情,故D错误.
故选:B.
点评 本题以医药上常用的治疗胃病的药物为情境,考查了物质性质,将化学与医药联系在一起,达到学以致用的目的.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
 ,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m+2-a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维中所用材料为二氧化硅,而硅可用作半导体材料 | |
| B. | 丁达尔效应可以区分溶液与胶体 | |
| C. | CO2、SiO2都是酸性氧化物,都能溶于水和碱,都不能和任何酸反应 | |
| D. | 金属钠、镁失火都不能用二氧化碳灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
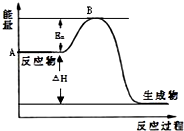 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰升华和液溴挥发 | B. | 金刚石熔化和金属铜熔化 | ||
| C. | 蔗糖溶于水和H2SO4溶于水 | D. | 食盐粉碎和干冰粉碎 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H10O的醇共有4种 | |
| B. | 包装用的材料聚乙烯和聚氯乙烯都属于烃 | |
| C. | 乙酸( CH3COOH)与油酸(C17H33COOH)互为同系物 | |
| D. | 淀粉、纤维素的分子式都是(C6H10O5)n,二者互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com