
ˮ��һ����Ҫ����Ȼ��Դ���������������治��ȱ�ٵ����ʡ�ˮ������ֱ��Ӱ�����彡������ش��������⣺
(l)��Ȼˮ���ܽ��������Ҫ��____��____ ______���ѧʽ����
(2)��������ˮ�Ĵ���ʱ��������еķ����Dzⶨˮ��____��
(3)ˮ�ľ����������������ǣ�ˮ�ľ������û��������������ȣ�ʹ____����ˮ��������(4)��
(4)ͨ��ʩ��һ��ѹ��ʹˮ��������Ĥ��������ӻ����ӽ������Ӷ�ʹˮ���Ծ����ķ�����Ϊ____��������������ˮʱ��ʹ����ͨ����Ĥ���ƶ�����____��
(5)ij��Ȼˮ�С�c(Ca2+)=1.2��10-3mol/L, c(Mg2+)=6��10-4mol/L, c(HCO3-)=8��10-4mol/L
Ҫ����10 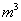 ������Ȼˮ�����ȼ���Ca(OH)2_______g���ټ���Na2CO3_______g��
������Ȼˮ�����ȼ���Ca(OH)2_______g���ټ���Na2CO3_______g��
 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ɫʯ����Һ�м������Na2O2��ĩ������ȷ�������ǣ� ����
A�������Һ����ɫ
B����Һ�ȱ���ɫ�����ɫ
C����Һ��Ϊ��ɫ
D����ΪNa2O2��ʯ���������ԭ��Ӧ�������ݲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ֶ�����Ԫ��X��Y������ɻ�����XY3����Y��ԭ������Ϊmʱ��X��ԭ������Ϊ����m��4����m��4����m��8����m��2����m��6��������ȷ�������(����)
A���٢ڢܡ���������B���٢ڢ� C���٢ڢۢ� D���٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
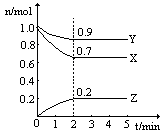
ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
��1���÷�Ӧ�Ļ�ѧ����ʽΪ
��2���ӿ�ʼ��2min��Z��ƽ����Ӧ����Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ԭ��Ľṹ��ʽ��ͼ��ʾ�����й���ԭ���˵������ȷ����
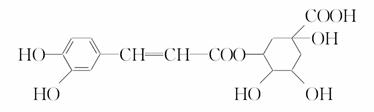
A������ʽΪC16H18O9
B��0.1 mol��ԭ�������0.8 mol NaOH��Ӧ
C������Na2CO3��Ӧ
D���ܷ���ȡ����Ӧ����ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ������������������ء�����������ȷ����(����)
A��ú�ĸ����ʯ�͵ķ��������ѧ�仯
B��BaSO4��ҽѧ���������ͣ�Ba2����������
C��14C��������������������14C��12C��Ϊͬ��������
D��������ע��Һ���ܲ���������������ڽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ȼ�ѧ����ʽ��S(s)��O2(g)===SO2(g)����H��a kJ��mol��1(a����297.2)����������˵�������в���ȷ����(����)
A��S(s)��O2(g)��ȼ�յķ�Ӧ�Ƿ��ȷ�Ӧ
B��S(g)��O2(g)===SO2(g)����H��b kJ��mol��1����a>b
C��1 mol SO2(g)�����е���������1 mol S(s)��1 mol O2(g)�����е�����֮��
D��16 g�������ڿ����г��ȼ�գ�������148.6 kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���л�ѧ��Ӧ�����ӷ���ʽ��д��ȷ����
A������ͨ���Ȼ�������Һ�У�Fe2+��Cl2== 2Cl����Fe3+
B��������ˮ��Ӧ��Cl2 + H2O== Cl��+ ClO�� + 2H+
C��ͭ��ϡ���ᷴӦ��3Cu + 8H+ + 2NO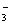 == 3Cu2+ + 2NO�� + 4H2O
== 3Cu2+ + 2NO�� + 4H2O
D.���Ȼ����м�������İ�ˮ��Al3++4 NH3��H2O = AlO2�� +4 NH4+ + 2 H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ȥ������Һ�е����ʣ������ڵ����ʣ���������������ȷ���ǣ�����
����A��NaCl��Һ��BaCl2������Na2SO4��Һ������
����B��KNO3��Һ��AgNO3������NaCl��Һ������
����C��NaCl��Һ��I2�����Ӿƾ�����Һ
����D��KNO3��Һ��I2���������Ȼ�̼����Һ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com