
| A.浓硫酸 | B.碱石灰 | C.AlCl3溶液 | D.食盐水 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:问答题
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
| 指示剂 | 变色范围 (pH) | 各范围内颜色 | ||
| 前 | 中间 | 后 | ||
| 甲基橙 | 3.1~4.4 | 红 | 橙色 | 黄 |
| 石蕊 | 5.0~8.0 | 红 | 紫色 | 蓝 |
| 酚酞 | 8.2~10.0 | 无 | 粉红 | 红 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
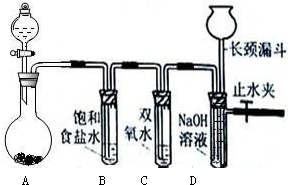
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.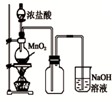 如图中:即使MnO2过量,盐酸也不能全部消耗 |
B. 如图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
C.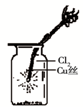 如图中:生成棕色的烟 |
D.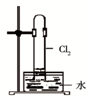 如图中:水可以充满试管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4Cl稀溶液、NaOH稀溶液、碱石灰 |
| B.饱和氨水、NaOH固体、五氧化二磷固体 |
| C.NaOH溶液、NH4Cl晶体、浓H2SO4 |
| D.NH4Cl固体、消石灰、碱石灰 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
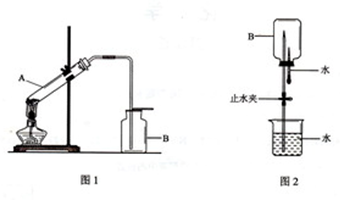
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验室制备NH3可用NaOH固体和浓氨水为原料方便制得 |
| B.二氧化硅是生产光纤制品的基本原料 |
| C.工业制水泥、玻璃、陶瓷都要用到石灰石为原料 |
| D.工业上可利用铝热反应原理制备高熔点金属 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
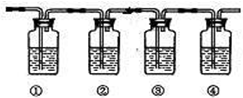
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
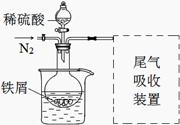
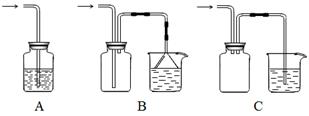
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com