
��ԭ�������Ǵ�������(��Cr2O72-��CrO42-)��ҵ��ˮ�ij��÷������������£�

��֪ת�������еķ�ӦΪ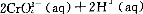
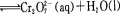
ת����������Һ�и�Ԫ�صĺ���Ϊ28.6 g��L�� CrO42-��10/11ת��ΪCr2072-������˵������ȷ����
A����Һ��ɫ���ֲ��䣬˵���������淴Ӧ�ﵽƽ��״̬
B�������̷�(FeS04��7H2O)����ԭ��������1 L��ˮ��������Ҫ458.7g
C��������ת����Ӧ��ƽ�ⳣ��K=1��1014����ת����������Һ��pH=5
D��������Ksp=1��10-32��Ҫʹ�������ˮ�е�c(Cr3+)����1��10-5mol��L��Ӧ����Һ��pH=5
 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ������ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�ѧ֪ʶ����������ȷ����
A��C��S��N���γɵ��������Ϊ����������
B����ˮ��ʯ��������ΪCaCO3��CO2��ˮ�����˻�ѧ��Ӧ
C��������ˮ��������KAl(SO4)2��Ư�۶���ǿ�����
D��232Th ת���233U�ǻ�ѧ�仯��233U��235U�Ļ�ѧ���ʼ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������ʡ������ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ���ҹ���ѧ�ҽ������ϳɵ����־���Ȳ��������ӵĽṹʽ��
����˵����ȷ����
A��A��B������һ��������ˮ�⣬��ˮ����������ֲ���
B��Aˮ�����ɵĸ߷��ӻ�����ĵ���������̼ԭ��һ������
C��A��B�������о�����2����������̼ԭ��
D��1molA��B�����ȼ�Һ��Ӧ�����������2n mol NaOH[
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ�����и�һ����ѧ��ѧ�Ծ��������棩 ���ͣ������
��ͼ�ǻ�ѧʵ���г��õļ���װ�á�
��ش��������⣺
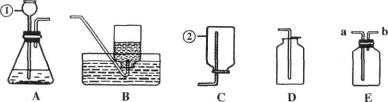
��1��ָ���б�ŵ��������ƣ��� ���� ��
��2����������A��Dװ�õ���Ͽ�����ȡ��һ�������� ��д��ʵ������ȡ������Ļ�ѧ��Ӧ����ʽ ��
��3������Eװ���ռ������壬������Ӧ�� ��ѡ��a����b�������룻����Eװ�ø������ɵ����壬E��ʢ�ŵ�Һ���Լ��� ��
��4����ʵ������ʹ��̼������ϡ���ᡢѡ��Aװ���ƶ�����̼����Ҫ��Aװ�ý��еĸĽ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ��ʡ��һ��ѧ����ѧ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���и��������У����������Ժ��ֱ�����ϣ�ֻҪ������һ�������ȼ�պ����ɵĶ�����̼�����������
A����ϩ(C2H4)�ͱ�(C6H6) B���Ҵ��ͱ���(CH3CH2CH2OH)
C���Ҵ�������(C2H5OC2H5) D����ȩ( HCHO)������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ�ʡ��һ�ϵ������¿���ѧ�Ծ��������棩 ���ͣ������
ij��ѧ�С�������ͼ��ʾ�����ּг�װ������ȥ��ʵ��װ�ã���̽����ʪ��Cl2��Na2CO3��Ӧ�õ��Ĺ������ʡ�

��1��װ��A�з�����Ӧ�����ӷ���ʽΪ_____________________________��
��2����ʵ��װ�����Դ��ڲ���֮�����Ľ��Ĵ�ʩΪ____________________
��3����֪��װ��C��ͨ��һ�����������۲쵽���D���лƺ�ɫ�����壨��ʾ����һ���ȵ����������֪C�����ù��庬��NaHCO3���ֶ�C�еijɷֽ��в����̽����
������������裮
����һ���������ֳɷ֣�ΪNaHCO3��NaCl
��������������ֳɷ֣�ΪNaHCO3��Na2CO3��NaCl
����Ʒ�����ʵ�飮���ڱ�����д��ʵ�鲽���Լ�Ԥ������ͽ��ۣ�
��ѡ�Լ�������������ˮ��ϡ���ᡢBaCl2��Һ������ʯ��ˮ��AgNO3��Һ���Թܡ�С�ձ���

���ۣ��ɲ���3�Ľ��۽�ϲ���2�е�a�������һ�������ɲ���3�Ľ��۽�ϲ���2�е�b��������������
��C����0.1molCl2ǡ����10.6gNa2CO3��Ӧ���Ҽ���һ�������ɴ˿���֪C�з�Ӧ���ɵ��ȵ�������Ϊ
��д��ѧʽ����д��C�з�����Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ�ʡ��һ�ϵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����������ʷ�����Ӧ����Na��O2 ��AlCl3�백ˮ �۴�����Һ��ϡ����
��Fe��Cl2��Ӧ��������Ӧ�����IJ�ͬ�����ɲ�ͬ�������
A���٢ڢۢ� B���٢ڢ� C���٢� D���٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ������ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ������
W��X��Y��Z���ֶ�����Ԫ�أ�ԭ�������������������ڱ���W��X���ڡ�Y��Z���ڣ���֪WԪ�ص��⻯����ZԪ�ص��⻯�ﷴӦֻ����һ����a��X��Yλ��ͬһ�壬���������YX2��YX3���ֳ����������ش��������⣺
��1��XԪ��λ�����ڱ���λ��Ϊ_____________________________________
��2��X��Y��Z����Ԫ���γɵĵ����У���������������___________���ѧʽ����
��3��a��Һ��pH__________7�����������������=�����������ӷ���ʽ����Ϊ��__________��
��4��Y��Z���γɹ��ۻ�����Y2Z2��������Y��Z������8�����ȶ��ṹ����Y2Z2�ĵ���ʽΪ__________��Y2 Z2��ˮ����Ӧ��������������ʹƷ����Һ��ɫ��������ˮ��Ӧ�Ļ�ѧ����ʽΪ______________________
��5����ҵ��������WH3����ȡWO���÷�Ӧ���Ȼ�ѧ����ʽΪ��
4WH3(g)+5O2(g)=4WO(g)+6H2O(g) ��H=-905.8kJ��mol-1��
��֪W2(g)+O2(g)=2WO(g) ��H=+180 kJ��mol-1����WH3��������Ӧ������������Ⱦ���ʵ��Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ӱ�ʡ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������Һ�и�����Ũ�ȹ�ϵ����ȷ����
A��0.1 mol��L��1 HCOOH��Һ�У�c(HCOO��)+c(OH��)=c(H��)
B��1 L 0.l mol��L��1CuSO4��(NH4)2SO4��6H2O����Һ�У�c(SO42��)>c(NH4��)>c(Cu2��)>c(H��)>c(OH��)
C��0.1 mol��L��1NaHCO3��Һ�У� c(Na��)+c(H��) =c(HCO3��)+2c(CO32��)+c(OH��)
D����V�������ʵ���Ũ�ȵ�NaX������HX��Ϻ����Һ�У�c(Na��)>c(HX)>c(X��)>c(H��)>(OH��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com