
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
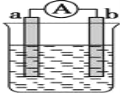
(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为:__________
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该装置__________(填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极材料:__________。当反应中收集到标准状况下224mL气体时,消耗的电极质量为__________g。
(3)燃料电池工作原理是将燃料和氧化剂(如O2)反应产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解液;则甲烷应通入________极(填a或b,下同),
【答案】2H++2e-=H2↑ 能 Al为负极,Mg为正极 0.18 b
【解析】
(1)Al、Cu、稀硫酸构成的原电池,金属铝做负极,金属铜为正极,正极上氢离子得电子生成氢气,正极的电极反应为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,由于能和氢氧化钠溶液反应的是金属铝,所以此时铝是负极失去电子,镁是正极,溶液中的氢离子放电产生氢气,所以在两电极上所发生的现象为负极铝片溶解,正极镁片上有气泡产生发生反应2H2O+2e-=H2↑+2OH-,标准状况下224mL气体为0.01mol氢气则转移0.02mol电子,故消耗Al的质量为![]() ,故答案为:能;Al为负极,Mg为正极;0.18;
,故答案为:能;Al为负极,Mg为正极;0.18;
(3)氢氧燃料电池中,燃料甲烷需通在负极,正极是氧气得电子,电子从负极流向正极,负极上甲烷失电子生成二氧化碳,则负极电极方程式为:CH4+2H2O-8e-=CO2+8H+;
故答案为:b。


科目:高中化学 来源: 题型:
【题目】下表标出的是元素周期表的一部分元素。
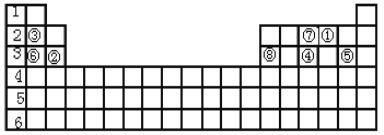
根据上表回答下列问题。
(1)元素①的原子序数是____,由元素①构成三原子单质的分子名称是____。
(2)元素④与⑦相比,____元素的原子半径较大,____元素的氢化物更稳定(用元素符号填写)。
(3)元素③与⑥相比,最高价氧化物对应水化物碱性较大的是________(填碱的化学式)。
(4)元素②和⑧的氧化物常用做耐火材料。元素②的氧化物的化学式是______,元素⑧的氢氧化物与烧碱溶液反应的化学方程式是____________。
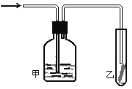
(5)如图,将潮湿的由元素⑤构成的单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是______。
a.稀硫酸 b.浓硫酸 c.水 d.饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
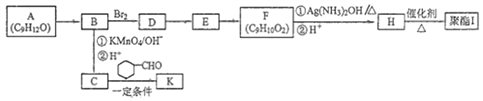
已知:
①A的苯环上只有一个支链,支链上有两种不同环境的氢原子
②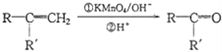 +CO2
+CO2
③RCOCH3+R'CHO![]() RCOCH=CHR'+H2O
RCOCH=CHR'+H2O
回答下列问题:
(1)A生成B的反应类型为__________,由D生成E的反应条件为_______________。
(2)H中含有的官能团名称为______________。
(3)I的结构简式为__________________________。
(4)由E生成F的化学方程式为____________________________________________。
(5)F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为:___________________。
①能发生水解反应和银镜反应
②属于芳香族化合物且分子中只有一个甲基
③具有5组核磁共振氢谱峰
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):___________________。
)为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期主族元素的原子序数依次增大。X、Y原子的最外层电子数之比为2∶3,Z+与Y2-核外电子排布完全相同,常温下,W的一种单质为淡黄色固体。下列说法不正确的是( )
A. 离子半径:W>Z>Y
B. 简单气态氢化物的热稳定性:Y>W
C. Y分别与X、Z、W能形成两种或两种以上的化合物
D. Z与Y、W分别形成的化合物溶于水,溶液均呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痛风性关节病的发病机理和尿酸钠有关。室温下,将尿酸钠(NaUr)的悬浊液静置,取上层清液滴加盐酸,溶液中尿酸的浓度c(HUr)与pH的关系如图所示。已知Ksp(NaUr)=4.9×10-5mol2·L-2,Ka(HUr)=2.0×10-6mol·L-1。下列说法错误的是( )
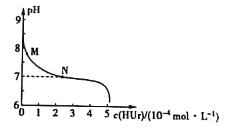
A.上层清液中,c(Ur-)=7.0×10-3mol·L-1
B.M→N的变化过程中,![]() 逐渐减小
逐渐减小
C.N点时,c(Cl-)=c(HUr)
D.当c(HUr)=c(Ur-)时,c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )
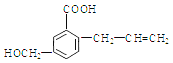
A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是
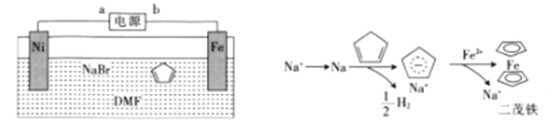
A.a为电源的正极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.二茂铁制备过程中阴极的电极反应为2H++2e-=H2↑
D.电解池的总反应化学方程式为Fe+2C5H6![]() Fe(C5H5)2+H2↑
Fe(C5H5)2+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE( )。
)。
①CH3CN中碳原子的杂化方式是 ____ 和_____ 。
②TCNE中第一电离能较大的是 ___(填元素符号),分子中所有原子____(填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为 ___(列出计算式)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
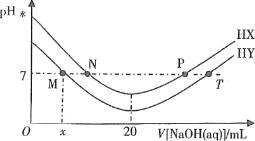
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com