
T℃时,pH = 2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示

(1)图中a点的值为
(2)若对上述硫酸再稀释10000倍则溶液中n (H+) :n(SO42-)=
(3)在T℃时,醋酸的电离平衡常数K=1.0×10-5, Kw=1.0×10-13则下列反应CH3COO-+H2O CH3COOH+OH- 的平衡常数K= 。
CH3COOH+OH- 的平衡常数K= 。
(4)在T℃时,取pH=2的硫酸溶液0.5Vml稀释到2Vml ,与0.1mol/L的NaOH溶液0.15Vml混合后稀释至10Vml,溶液的pH= 。
科目:高中化学 来源:2016届山东省高三11月月考化学试卷(解析版) 题型:填空题
(一)(1)钠及其化合物是中学化学常用物质,核潜艇或宇宙飞船常用过氧化钠做供氧剂,其原理是_______________________________、_______________________________(用化学方程式表示),若上述变化过程中消耗过氧化钠的质量为 23.4g,则变化过程中转移电子数为_____________个。
23.4g,则变化过程中转移电子数为_____________个。
(2)下列关于Na2O2的叙述正确的是__________
A.Na2O2中阴、阳离子的个数比为1∶1
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.取a g某物质在O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了a g,该物质可能是C6H12O6
D.Na2O2的漂白原理与SO2的漂白原理相同
E.Na2O2与水反应是水作还原剂的氧化还原反应
F.Na2O2与NaHCO3固体按物质的量之比1:1混合加热充分反应后,所得固体中Na2CO3和NaOH的物质的量之比亦为1:1
(二)切开的金属Na暴露在空气中,其变化过程如下:

(1)反应Ⅰ的反应过程与能量变化的关系如右图:

① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是_________________________________。
② 1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 _________________________________。
(2)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是 (填字母)。
Na2CO3溶液,下列说法正确的是 (填字母)。
A.升高温度,溶液的pH降低
B.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)
C.加入少量NaOH固体,c (CO32―)与c (Na+)均增大
D.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+)
(3) 钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因___________________________________。
② ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na 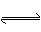 Ni + 2NaCl。其负极反应式是____________
Ni + 2NaCl。其负极反应式是____________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江台州中学高二上第三次统练化学试卷(解析版) 题型:选择题
分析下列反应在任何温度下均能自发进行的是
A.2N2(g)+O2(g) ═ 2N2O(g) △H=+163 kJ·mol-1
B.Ag(s)+ 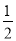 Cl2(g) ═ AgCl(s) △H= -127 kJ·mol-1
Cl2(g) ═ AgCl(s) △H= -127 kJ·mol-1
C.HgO(s) ═ Hg(l) + 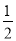 O2(g) △H=+91 kJ·mol-1
O2(g) △H=+91 kJ·mol-1
D.H2O2(l) ═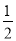 O2(g) + H2O(l) △H= -98 kJ·mol-1
O2(g) + H2O(l) △H= -98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德市高二12月月考化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.对于有气体参与的反应,增大压强,活化分子数增多,化学反应速率增大
B.对放热反应而言,升高温度,活化分子百分数减少,反应速率减小
C.活化分子间发生的碰撞为有效碰撞
D.使用催化剂,活化分子百分数增多,化学反应速率增大
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江齐齐哈尔实验中学高一上期中化学卷(解析版) 题型:选择题
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1:1:1时,实际参加反应的FeS与HNO3的物质的量之比为( )
A. 1:6 B. 1:7
C. 2:11 D. 16:25
查看答案和解析>>
科目:高中化学 来源:2016届河北邯郸第一中学高三一轮收官考试一理综化学卷(解析版) 题型:实验题
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为___________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
_____MnO4-+_____H2C2O4+____H+ = ____Mn2++_____CO2+____H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):
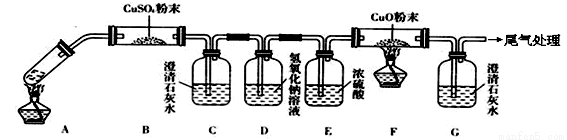
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
上述装置中,D的作用是______。乙二酸分解的化学方程式为__________。
(4)该小组同学将2.52g草酸晶体(H2C2O4·2 H2O)加入到100mL0.2mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是_______(用文字简单描述)。
(5)以上溶液中各离子的浓度由大到小的顺序为:_________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江余姚中学高二上学期期中考试化学试卷(解析版) 题型:填空题
如图所示,在不同的电解质溶液中可以组成不同的电池。
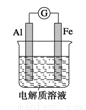
(1)①当电解质溶液为稀硫酸时,Fe电极是_____ (填“正”或“负”)极.其电极反应式为______
②当电解质溶液为NaOH溶液时,Al电极是____(填“正”或“负”)极.其电极反应式为______
(2)若把铝改为钢.电解质溶液为浓硝酸,则Fe 电极是_____(填“正”或“负”)极.其电极反应式为______。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东枣庄三中高二10月学情调查化学卷(解析版) 题型:选择题
下列叙述正确的是
A.电解饱和食盐水时,用铁作阳极,Cl- 发生氧化反应
B.铅蓄电池放电时,负极质量减轻,正极质量增加
C.马口铁(镀锡铁)镀层破损后即失去保护作用
D.钢铁发生电化学腐蚀的负极反应式:Fe-3e- == Fe3+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东湛江第一中学高二上第二次考试化学卷(解析版) 题型:选择题
臭氧是理想的烟气脱硝剂,其脱硝反应为: 2NO2(g)+O3(g)  N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度,平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2mol?L-1 | t1时仅加入催化剂,平衡正向移动 | 到达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com