

| ||
| ||


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| A、全部 | B、②③④⑥⑦ |
| C、①②③④⑤⑥ | D、①②③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 溶质 | Na2SO4 | BaCl2 | AlCl3 | FeCl3 |
| /mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
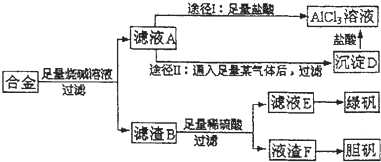
查看答案和解析>>
科目:高中化学 来源: 题型:

| 750℃ |
| 750℃ |
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.( 1)在一个体积为2L的密闭容器中充入6mol SO2和3mol O2,进行下列反应2SO2(g)+O2(g)?2SO3(g),保持温度不变,2min后达到平衡,测得混合气体中O2的体积分数为25%,用SO2浓度变化来表示的化学反应速率为
Ⅰ.( 1)在一个体积为2L的密闭容器中充入6mol SO2和3mol O2,进行下列反应2SO2(g)+O2(g)?2SO3(g),保持温度不变,2min后达到平衡,测得混合气体中O2的体积分数为25%,用SO2浓度变化来表示的化学反应速率为
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性氧化物一定是金属氧化物 |
| B、正四面体分子中键角一定是109°28′ |
| C、在D216O中,质量数之和是质子数之和的两倍 |
| D、非金属氧化物一定是酸性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com