
(1)离子化合物本来就是由离子组成的,在离子化合物中不存在分子。离子化合物无论是溶于水还是熔化状态,都是以离子的形式存在,而不存在分子。即离子化合物溶于水或受热熔化以后,都完全电离为自由移动的离子,故离子化合物都是强电解质。
(2)氯化铝是共价化合物,而不是离子化合物,它是强电解质,原因是氯化铝在水溶液中的电离是完全电离。
(3)碳酸氢钠、硫酸氢钠等酸式盐,一般为强电解质,因为它们的电离是完全电离,如碳酸氢钠溶于水后的电离:NaHCO3====Na++![]() (易);
(易);![]()
![]() H++
H++![]() (难)。硫酸氢钠溶于水后的电离:NaHSO4====Na++ H++
(难)。硫酸氢钠溶于水后的电离:NaHSO4====Na++ H++![]() ;硫酸氢钠受热熔化后的电离:NaHSO4====Na++
;硫酸氢钠受热熔化后的电离:NaHSO4====Na++![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| H | + 4 |
| O | - 2 |
| H | + 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了防治酸雨,减少煤燃烧时向大气排放的SO2,工业上通过生石灰和含硫的煤混合使用可以“固硫”(避免硫化合物进入大气),最后生成石膏。试回答:
(1)整个“固硫”反应所涉及的反应类型包括:①化合②分解③置换④复分解⑤氧化还原反应⑥非氧化还原反应⑦离子反应⑧非离子反应(分子反应)。其中正确的是
A.①⑤⑥⑦ B.①②③⑤⑧ C.①⑤⑥⑧ D.②④⑤⑦
(2) 第一步“固硫”反应的化学方程式中所需气态物质的化学计量数之和为
A.1 B. 2 C.3 D.4
(3)比较此法与“石灰石粉末与含硫煤混合”法哪个更好些?为什么?
(4)你认为减少酸雨产生可采取的措施是
①少用煤作燃料②把工厂的烟囱造高 ③先将燃料煤脱硫 ④在土壤中加石灰防止酸化 ⑤开发新能源,避免含S、N的氧化物大量排放
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
(9分)NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。
请回答下列问题。
(1)对NO的叙述正确的是________(填序号)。
A.NO是一种无色有毒的气体 B.常温、常压下,NO难与空气中的O2化合
C.含等质量氧元素的NO和CO的物质的量相等 D.NO易溶于水,不能用排水法收集
(2)NO对环境的危害在于________(填序号)。
A.破坏臭氧层 B.高温下能使一些金属被氧化 C.造成酸雨 D.与人体血红蛋白结合
(3)在含Cu+的酶的活化中心中,亚硝酸根离子可转化为NO。写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式为:_________________________________________。
(4)在常温下,把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力的2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式:___________________________________________。
(5)解释变化(4)中为什么最后的气体总压力小于原压力的2/3?
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省宁波市十校联考理综化学试卷(解析版) 题型:选择题
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3 + S  Na2S2O3,常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。

Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
(1)仪器2的名称为 ,
装置6中可放入 。
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液

(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2 =Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3+S Na2S2O3
Na2S2O3
总反应为:2Na2S+Na2CO3+4SO2= 3Na2S2O3+CO2
随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出,继续通二氧化硫气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液PH要控制不小于7理由是
(用离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并标定溶液的浓度:

(1)为减少产品的损失,操作①为 ,操作②是抽滤洗涤干燥,其中洗涤操作是用
(填试剂)作洗涤剂。
(2)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高
(3)称取一定质量的产品配置成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准
确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加
水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴
淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,滴定终点的现象为
三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液
的浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河南省信阳市高三第二次调研考试化学试卷 题型:填空题
(18分)(1)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O,
写出该反应的化学方程式并配平_________________________________。若反应过程中
转移了0.3mol电子,则氧化产物的质量是____________g。
(2)同一物质呈气态的熵值最大,液态的熵值次之,固态的熵值最小。若同温同压下一个化学反应生成物气体的体积等于反应物气体的体积就可以粗略认为该反应的熵变为0。某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
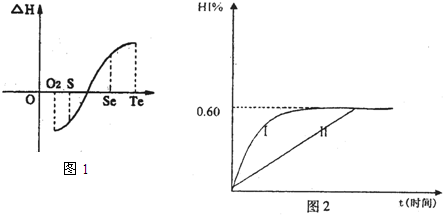
a.碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
b.等物质的量氧气、硫、硒、碲与H2反应的焓变情况如图l所示:
请回答下列问题:
H2与硫化合的反应______________热量(填“放出”或“吸收”)。根据题目所给信息,请解释为什么Te和H2不能直接化合_________________________________________.
(3)在复杂的反应中,要考虑反应的先后顺序。已知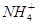 +
+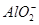 +2H2O
+2H2O Al(OH)3↓ +NH3·H2O,向含有等物质的量的
Al(OH)3↓ +NH3·H2O,向含有等物质的量的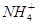 、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中:
、Al3+、H+混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中:
第二个离子反应的离子方程式是__________________________________.
最后—个离子反应的离子方程式是________________________________.
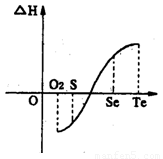
(4)将1mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g) 2HI(g);△H<0。 并达平衡。HI的体积分数HI%随时问变化曲线如图2所示:
2HI(g);△H<0。 并达平衡。HI的体积分数HI%随时问变化曲线如图2所示:
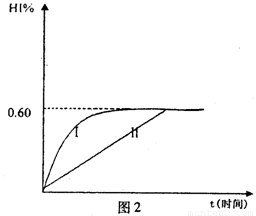
①达到平衡时,I2(g)的物质的量浓度为________mol/L.
②保持加入的反应物的物质的量不变,若改变反应条件,在某一条件下HI%的变化如曲线l所示,则该条件可能是(写出所有的可能性)___________________________________________________________在这种条件下,平衡常数K值____________(填“增大”、“变小”、。不变”或“可能变大也可能变小”)
③若保持温度不变,在另一相同的2L密闭容器中加入1molH2(g)和2molHI(g),发生反应达到平衡时,H2的体积分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com