
 目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:
目前半导体生产展开了一场“铜芯片”革命--在硅芯片上用铜代替铝布线,古老的金属铜在现代科技应用上取得了突破,用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如下:分析 (1)Cu位于第四周期ⅤⅡB族,是29号元素,基态铜原子的价电子排布式为1s22s22p63s23p63d104s1;同主族元素第一电离能自上而下逐渐减小;
(2)由(1)分析知反应①②生成的相同气体分子是SO2,SO2中价层电子对个数=2+$\frac{1}{2}$(6-2×2)=3,且含有一个孤电子对,所以其空间构型是V型,S原子采用sp2杂化;
(3)硫酸铜溶液与氨水生成氢氧化铜,氢氧化铜溶于过量的氨水,形成[Cu(NH3)4]2+离子,离子中存在共价键、配位键;
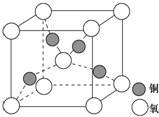
(4)铜晶体中铜原子堆积模型为面心立方最密堆积,由均摊法计算氧化亚铜晶胞中Cu原子和O原子的数目,根据密度计算公式ρ=$\frac{m}{V}$计算出体积,再计算铜原子与氧原子之间的距离即可.
解答 解:(1)Cu位于第四周期ⅤⅡB族,是29号元素,基态铜原子的价电子排布式为3d104s1;同主族元素第一电离能自上而下逐渐减小,所以第一电离能较大的是氧,
故答案为:3d104s1;O;
(2)由(1)分析知反应①②生成的相同气体分子是SO2,SO2中价层电子对个数=2+$\frac{1}{2}$(6-2×2)=3,所以S原子采用sp2杂化,由于含有一个孤电子对,其空间构型是V形,
故答案为:sp2;V形;
(3)硫酸铜溶液与氨水生成氢氧化铜蓝色沉淀,氢氧化铜溶于过量的氨水,形成[Cu(NH3)4]2+离子,蓝色沉淀溶于氨水的离子方程式为Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,深蓝色透明溶液中的阳离子(不考虑H+)内存在的全部化学键类型有共价键、配位键,
故答案为:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O;共价键、配位键;
(4)铜晶体中铜原子堆积模型为面心立方最密堆积,在铜的某种氧化物晶胞中,O原子在晶胞的顶点和体心,故O原子数=$\frac{1}{8}$×8+1=2,Cu原子全部在体心,故Cu原子数=4,即一个氧化亚铜晶胞中有2个O原子和4个Cu原子,根据密度计算公式ρ=$\frac{m}{V}$可知,体积V=$\frac{m}{ρ}$=$\frac{\frac{288}{{N}_{A}}}{d}$=$\frac{288}{d•{N}_{A}}$cm3,所以晶胞的边长为$\root{3}{\frac{288}{d•{N}_{A}}}$cm,根据晶胞的结构图可知,晶胞中铜原子与氧原子之间的距离晶胞边长的$\frac{\sqrt{3}}{4}$,所以该晶胞中铜原子与氧原子之间的距离为$\frac{\sqrt{3}}{4}$$\root{3}{\frac{288}{d•{N}_{A}}}$cm=$\frac{\sqrt{3}}{4}$$\root{3}{\frac{288}{d•{N}_{A}}}$×1010pm,
故答案为:面心立方最密堆积;$\frac{\sqrt{3}}{4}$$\root{3}{\frac{288}{d•{N}_{A}}}$×1010.
点评 本题主要考查晶胞的计算,题目难度中等,涉及核外电子排布、杂化轨道方式以及分子构型和配合物的内容,注意掌握均摊法在晶胞计算中的应用,试题综合性较强,充分考查了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 往某溶液中加入稀NaOH溶液,无刺激性气味的气体产生,说明该溶液一定不含NH4+ | |
| B. | 用加热的方法可以除去混在NaCl固体中的NH4Cl,说明NH4Cl会升华 | |
| C. | SO2气体和Cl2均能使品红溶液褪色,说明两者均有强氧化性 | |
| D. | 浓硫酸可用来干燥H2、Cl2、SO2等气体,说明浓硫酸具有吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的组成可以用H3+表示 | B. | 它比普通氢分子多一个氢原子核 | ||
| C. | 它一定含3个中子 | D. | 可以推测它的化学性质与H2不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,11.2L氧气中所含有的原子数为NA | |
| B. | 17g的NH3分子中含有的电子数为10NA | |
| C. | 常温常压下,48g O3含有的氧原子数为3NA | |
| D. | 标准状况下,11.2LH2O中所含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
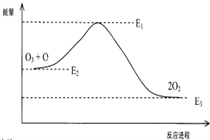
| A. | △H=△H1+△H2 | |
| B. | ClO中含有极性共价键 | |
| C. | 反应O3+O→2O2的△H=E1-E3 | |
| D. | 氯原子改变了该反应的历程,但不影响△H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类大规模开发、利用金属,铁比铝早 | |
| B. | 依据酸碱质子理论HCO3-是酸碱两性物质 | |
| C. | 因为铜比铁不活泼,所以铜与氯化铁溶液不会发生化学反应 | |
| D. | 煤燃烧前加入适量的石灰可以减少污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6O | B. | C2H4O | C. | C2H6O2 | D. | CH4O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com