
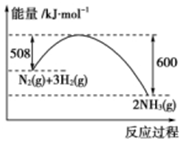
 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:分析 (1)16g固体硫为0.5mol,完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kJ热量;
(2)图象分析可知是1molN2与和3molH2完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,据此写出反应的热化学方程式.
解答 解:(1)16g固体硫完全燃烧时放出148.4kJ的热量,即1molS完全燃烧时放出放出296.8kJ热量,则热化学方程式为:S(s)+O2(g)=SO2(g),△H=-296.8 kJ/mol,
故答案为:S(s)+O2(g)═SO2(g)△H=-296.8 kJ•mol-1;
(2)图象分析可知,图象中表示的是1molN2与和3molH2氧气完全反应生成2molNH3,反应是放热反应,反应的焓变△H=508kJ/mol-600kJ/mol=-92kJ/mol,反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1 ,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1.
点评 本题考查化学反应中的能量变化及利用盖斯定律确定反应及其能量的关系,为高频考点,侧重考查学生的分析能力和计算呢利益,题目难度中等,注重基础知识的考查.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 80g硝酸铵中含有氮原子数为NA | |
| B. | 0.lmolN5+离子中所含的电子数为3.4 NA | |
| C. | 2mol金属铝与足量的盐酸反应,共失去了4NA个电子 | |
| D. | 16 g氧气和16 g臭氧所含的原子数均为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| B. | 12g石墨和C60的混合物中质子总数一定为6NA | |
| C. | 25℃时,1L mol•L-1FeCl3溶液中含有0.1NA个Fe(OH)3胶体粒子 | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1 CaCl2溶液 | ||
| C. | 150 mL 3 mol•L-1 KCl溶液 | D. | 75 mL 3 mol•L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
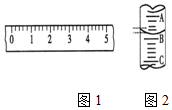 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在表中填空,表示称量过程,并在如图1所示的游码尺上画出游码的位置(画“|”表示).| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取CuSO4:Cu$\stackrel{浓H_{2}SO_{4}、△}{→}$CuSO4 | |
| B. | 制取Cu(NO3)2:Cu$\stackrel{O_{2}、△}{→}$ $\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| C. | 制取Al(OH)3:Al$\stackrel{NaOH}{→}$ $\stackrel{H_{2}SO_{4}}{→}$Al(OH)3 | |
| D. | 制取Na2CO3:Na$\stackrel{O_{2}}{→}$ $\stackrel{CO_{2}}{→}$Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com