
铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为???????????????????? 。N、O、S三种元素的第一电离能大小顺序为???????????????????????? (填元素符号)。
②Cu(NH3)4SO4中所含的化学键有????????????????????????
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。根据等电子体原理,CO分子的结构式为???????????? 。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为??????????? 。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为??????????? 。

(4)Cu2O的晶胞结构如图所示,该晶胞的边长为a cm,则Cu2O的密度为??????????? g·cm-3(用NA表示阿伏加德罗常数的数值)。

(1)①1s22s22p63s23p63d10(或[Ar]3d10)(2分)?????? N>O>S(2分)
②(极性)共价键、离子键、配位键(3分,答对1个得1分,有错不得分)
(2)C≡O(2分)
(3)sp3杂化 (2分) K2CuCl3(2分)
(4)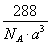 (2分)
(2分)
【解析】
试题分析:(1)①NH4CuSO3种铜为+1,铜原子的价电子排布为3d104s1,失去最外层的1个电子,故为1s22s22p63s23p63d10,N原子2p上是半充满的稳定结构,故第一电离能N>O,O>S;②氨气分子和硫酸根离子中有极性键,氨气分子和铜离子形成配位键,铜离子和硫酸根离子形成离子键;(2)CO和N2是等电子体,根据N2的结构式得出CO的结构式;(3)a位置上的Cl形成了2条单键,还有2对孤对电子,故为sp3杂化;当铜为+2价时为KCuCl3,当铜为+1价时,为K2CuCl3;(4)该晶胞中有2个铜和4个氧,故该晶胞的质量等于密度乘以体积,也等于摩尔质量除以NA再乘以2,列等式求出密度的表达式。
考点:考查核外电子排布、化学键类型的判断、杂化轨道类型的判断、等电子体原理、晶胞的计算


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:阅读理解
 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.
碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛.| 2880 |
| NA |
| 2880 |
| NA |


| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省成都七中高二(上)期末化学试卷(解析版) 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省雅安中学高二(上)月考化学试卷(10月份)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com