
【题目】下列反应的离子方程式正确的是
A. 过氧化钠与水反应:2O22-+2H2O=O2↑+4OH-
B. NaOH溶液与氯化铵溶液共热:OH-+NH4+![]() NH3↑+H2O
NH3↑+H2O
C. 氯气与水反应:Cl2+H2O![]() Cl-+ClO-+2H+
Cl-+ClO-+2H+
D. 氯化铁溶液刻蚀铜电路板:Fe3++Cu=Cu2++Fe2+
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法中,不正确的是( )
A.合金的性质与其成分金属的性质不完全相同
B.工业上金属Mg、Al都是电解熔融氯化物制得的
C.金属冶炼的本质是金属阳离子得到电子变成金属单质
D.越活泼的金属越难冶炼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L 盐酸 | pH = 3盐酸 | 0.1mol/L 氨水 | pH = 11氨水 |
下列说法正确的是
A. 由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①与③混合,若溶液pH = 7,则V(盐酸)>V(氨水)
D. ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+)
【答案】D
【解析】试题分析:A.相同浓度的氨水与盐酸,氨水实际上还会促进水的电离,所以由水电离产生的c(H+):①>③,B.如果③是强碱的话,稀释100倍,其pH一定为11,但是关键氨水是弱碱,无论稀释到什么程度,都会有未电离的氨水存在,所以pH一定比11要小。C.①与③混合得到的是氯化铵,氯化铵是强酸弱碱盐,显酸性,所以若想要其pH为7,则氨水的用量一定要比盐酸的用量大才可以。D.所得溶液显碱性,所以氢氧根离子的浓度一定要比氢离子的浓度大,而且铵根离子的浓度要比氯离子的浓度大。
考点:考查了弱电解质的电离平衡、盐类水解、离子浓度的大小比较的相关知识。
【题型】单选题
【结束】
18
【题目】25℃时,常见的无机酸在水溶液中的电离子平衡常数如表,下列选项正确的是( )
氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
K=4.9×10﹣10 | K1=4.4×10﹣7 K2=4.7×10﹣11 | K=6.61×10﹣4 |
A. 氰化钠溶液中通入少量CO2:2CN﹣+H2O+CO2═2HCN+CO32﹣
B. NaCN与HCN的混合溶液中一定有:c(Na+)>c(CN﹣)>c(HCN)>c(H+)>c(OH-)
C. 25℃时CN-的水解平衡常数约为1.6×10-5
D. NaCN与HCN的混合溶液中:2c(Na+)=c(CN-)+c(HCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是组成细胞的主要元素及其比例。根据图示信息完成下列问题:

(1)构成细胞的基本元素有____________。
(2)组成生物体的最基本元素占细胞鲜重的________。
(3)________元素在细胞鲜重总量中所占比例最大,主要是因为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④B.⑤⑥⑦⑧C.③⑤⑥⑦⑧D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用生产甲醇的废催化剂(主要成分为ZnO和CuO,还含有少量有机杂质等)制散CuCl和ZnO的工艺流程如下:
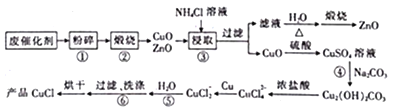
已知用NH4Cl溶液设取时.发生的主要反应如下,
ZnO(s)+2NH4Cl(aq)![]() Zn(NH3)2Cl2(aq)+H2O(l)K1=0.042
Zn(NH3)2Cl2(aq)+H2O(l)K1=0.042
CuO(s)+2NH4Cl(aq)![]() Cu(NH3)2Cl2(aq)+H2O(l)K2=0.0065
Cu(NH3)2Cl2(aq)+H2O(l)K2=0.0065
回答下列同题:
(1)预处理时,废催化剂需进行“粉碎”的主要目的是________;步骤②中“煅烧”的目的是______________。
(2)步骤④发生反应的离子方程式为______________________________。
(3)步骤⑤加H2O稀释的目的是____________________________________________。
(4)步骤⑥过滤、洗涤时,若要检验是否洗涤干净,其实验操作是_____________________。
(5)准确称取mg产品CuCl,将其溶于稍过量的FeCl3溶液中,充分溶解后、加入适量的稀硫酸,用cmol·L-1的K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液的体积为VmL。已知滴定时Cr2O72-被还原为Cr3+,则滴定过程中发生反应的离子方程式为______________________;该反应中氧化剂与还原剂的物质的量之比为________;该产品中CuCl的质量分数为________(用含c、m、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮气是制备含氮化合物的重要原料,而含氮化合物的用途广泛。回答下列问题:
(1)两个常见的固氮反应为:
N2(g)+O2(g)![]() 2NO(g)…………(Ⅰ)
2NO(g)…………(Ⅰ)
N2(g)+3H2(g)![]() 2NH3(g)…………(Ⅱ)
2NH3(g)…………(Ⅱ)
①气相反应中,某物质A 的组成习惯用分压p(A)代替浓度c(A),相应的平衡常数用Kp表示。反应(Ⅰ)的平衡常数表达式Kp=_________________。
②反应(Ⅱ)在不同温度下的平衡常数Kp如下表:
温度/K | 298 | 473 | 673 |
Kp | 62(KPa)-2 | 6.2×10-5(KPa)-2 | 6.0×10-8(KPa)-2 |
则反应(Ⅱ) 的ΔH________0(填“>”、“<”或“=”)
(2)合成氨工业中原料气所含的少量CO对合成塔中的催化剂有害,可由“铜洗”工序实现对原料气精制。有关反应的化学方程式如下:
[Cu(NH3)2]Ac(aq)+CO(g) +NH3(g)![]() [Cu(NH3)3] ]Ac·CO(aq)
[Cu(NH3)3] ]Ac·CO(aq)
ΔH=-35 kJ·mol-1,用化学平衡移动原理分析该工序生产的适宜条件为________________________。
(3)氨气是工业制硝酸的主要原料。T℃时,NH3和O2可能发生如下反应:
①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H= -907kJmol-1
4NO(g)+6H2O(g) △H= -907kJmol-1
②4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H= -1269kJmol-1
2N2(g)+6H2O(g) △H= -1269kJmol-1
其中②是副反应。若要减少副反应,提高NO的产率,最合理的措施是___________________;
T℃时N2和O2反应生成NO的热化学方程式为________________________________。
(4)生产和实验中常采用甲醛法测定铵盐的含氢量。反应原理如下:
4NH4++6HCHO==(CH2)6N4H+(一元酸)+3H++6H2O
实验步骤如下:
①取铵盐样品溶液a mL,加入稍过量的甲醛溶液(已除去其中的酸),静置1分钟;
②滴入1-2滴酚酞溶液,用cmol·L-1的氢氧化钠溶液滴定至溶液呈粉红色且半分钟内不褪去为止,记录消耗氢氧化钠溶液的体积;
③重复以上操作2 次,三次实验平均消耗氢氧化钠溶液VmL。
则样品中的含氮量为____mg·L-1;下列铵盐不适合用甲醛法测定含氮量的是____________(填标号)。
a.NH4HCO3 b. (NH4)2SO4 c.NH4Cl d.CH3COONH4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com