
硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:①二氧化硫的制取和净化;②二氧化硫转化为三氧化硫;③三氧化硫的吸收和硫酸的生成。
问题1:设空气中N2、O2的含量分别为0.80和0.20(体积分数),则110 L空气和足量的FeS2完全反应后,气体体积(同温同压)变为L。
问题2:为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| 1 | 3.62 | 50.00 | 0.896 |
| 2 | 7.24 | 50.00 | 1.792 |
| 3 | 10.86 | 50.00 | 2.016 |
| 4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测:用1.81 g样品进行同样实验时,生成氨气的体积(标准状况)为 L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(3)求所用NaOH溶液的物质的量浓度。(写出计算过程)
问题1:104
问题2:(1)0.448 (2)1∶2 (3)3.00 mol·L-1
问题1:由题意,空气中O2的含量为0.20,则110 L空气中V(O2)=110 L×0.20=22 L。
4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
11 L 8 L
22 L V(SO2)
V(SO2)=16 L,则反应后气体体积V(N2)+V(SO2)=110 L×80%+16 L=104 L
问题2:由题给数据,第2组样品质量是第1组的2倍,产生NH3体积也是第1组的2倍;第3组样品质量是第1组的3倍,但产生NH3体积小于第1组的3倍,则NaOH溶液在第1、2组中足量,在第3组中不足。
(1)用1.81 g样品进行实验,NaOH过量,产生的NH3体积应为第1组的![]() ,即生成NH3的体积为0.448 L。
,即生成NH3的体积为0.448 L。
(2)计算(NH4)2SO4与NH4HSO4的物质的量之比,应根据第1组或第2组数据计算。
(NH4)2SO4~2NH3 NH4HSO4~NH3
设(NH4)2SO4物质的量为x,NH4HSO4物质的量为y,则有:
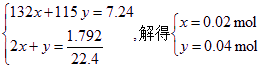
n〔(NH4)2SO4〕∶n(NH4HSO4)=1∶2
(3)NaOH溶液的物质的量浓度应根据第3组或第4组数据计算,当NaOH不足时,NaOH先中和NH4HSO4电离出的H+,然后再和![]() 反应。
反应。
由(2)可知第3组中n〔(NH4)2SO4〕=0.03 mol,n(NH4HSO4)=0.06 mol,则NH4HSO4电离的n(H+)=0.06 mol
H+~OH- ![]() ~OH-~NH3
~OH-~NH3
n(NaOH)=n(OH-)=n(H+)+n(NH3)=0.06 mol+![]() =0.15 mol
=0.15 mol
c(NaOH)=![]() =3.00 mol·L-1
=3.00 mol·L-1


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
问题1:设空气中N2、O2的含量分别为0.80和0.20(体积分数),则110 L空气和足量的FeS2完全反应后,气体体积(同温同压)变为 L。
问题2:为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
1 | 3.62 | 50.00 | 0.896 |
2 | 7.24 | 50.00 | 1.792 |
3 | 10.86 | 50.00 | 2.016 |
4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测:用1.81 g样品进行同样实验时,生成氨气的体积(标准状况)为 L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(3)求所用NaOH溶液的物质的量浓度。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
实验 | 序号样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
1 | 3.62 | 50.00 | 0.896 |
2 | 7.24 | 50.00 | 1.792 |
3 | 10.86 | 50.00 | 2.016 |
4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测,1.81 g样品进行同样实验时,生成氨气的体积(标况)为________ L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___________。
(3)求所有NaOH溶液的物质的量浓度为___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
硫酸铜是一种应用极其广泛的化工原料。制备硫酸铜是无机化学实验教学中一个重要的实验。由于铜不能与稀硫酸直接反应,实验中将浓硝酸分次加入到铜粉与稀硫酸中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
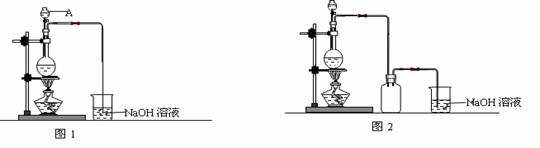
(1)图1中,A仪器的名称为 ,烧瓶中发生的离子反应方程式为 。
(2)图2是图1的改进装置,改进的目的是 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,反应完全后,向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。
(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。
a、CaO b、CuCO3 c、CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol/L的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1 h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4?5H2O 10.6g。
请回答下列问题:
③该反应的离子反应方程式为 。
④控制温度在50℃和60℃加热的原因为 ,晶体采用酒精淋洗的优点是
⑤上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”),理由是
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
硫酸铜是一种应用极其广泛的化工原料。制备硫酸铜是无机化学实验教学中一个重要的实验。由于铜不能与稀硫酸直接反应,实验中将浓硝酸分次加入到铜粉与稀硫酸中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
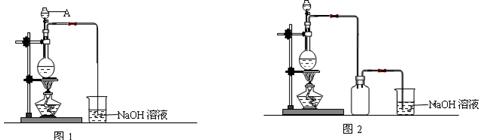
(1)图1中,A仪器的名称为 ,烧瓶中发生的离子反应方程式为 。
(2)图2是图1的改进装置,改进的目的是 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,反应完全后,向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。a、CaO b、CuCO3 c、CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol/L的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1 h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.6g。请回答下列问题:
③该反应的离子反应方程式为 。
④控制温度在50℃和60℃加热的原因为 ,晶体采用酒精淋洗的优点是 。
⑤上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”),理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com