
下列离子方程式书写正确的是( )
A.金属铝投入到氢氧化钠溶液中:2Al+2OH-=2 AlO +H2↑
+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH-=Al(OH)3↓
C.三氯化铁溶液中加入铁粉 Fe3++Fe = 2Fe2+
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2 = 2Fe3++2Cl-
科目:高中化学 来源: 题型:
下列说法中错误的是 ( )
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
A.①②③④ B.只有②③ C.只有③④ D.只有①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
有 15g铁和铁的氧化物组成的混合物,加入150ml稀硫酸,放出H21.68L(标准状况),铁和铁的氧化物均无剩余,向溶液中滴加KSCN溶液,未见颜色变化。向溶液中加入3mol.L-1的NaOH溶液200ml,恰好使Fe2+全部转化为Fe(OH)2,则原H2SO4溶液的物质的量浓度为( )
A .3mol.L-1 B .2.5mol.L-1 C.2mol.L-1 D1.5mol.L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
溶液中由水电离产生的c(OH—)=1×10—14mol·L-1,满足此条件的溶液中一定能大量共存的离子组是:
A. Al3+ Na+ NO3— Cl—
B. K+ Ba2+ Cl— NO3—
C. K+ Na+ Cl— CO32—
D. K+ NH4+ SO42— NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上一般以CO和H2为原料合成甲醇,该反应的热化 学方程式为:
CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H=-116kJ/mo
CH3OH ( g ) △H=-116kJ/mo
(1) 该反应的化学平衡常数表达式为 ;
(2)下列措施中有利于增大该反应的反应速率且提高转化率的是:
(填字母序号) 。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.使用高效催化剂 d.增大体系压强
(3 ) 一定条件下在2L密闭容器中,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇。
① 2min时测得生成CH3OH 0.2mol,则0~2min的平均反应速率v(H2)= 。
②反应5min后达到平衡,若平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号).
a.c ( H2 )减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡c ( H2 )/ c (CH3OH )减小
(4)在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生
成甲醇,CO的转化率(α)与温度(T)、压强(P) 的关系如图所示。
 ① A、C两点都表示达到的平衡状
① A、C两点都表示达到的平衡状
态,则自反应开始到达平衡状态所需的时间,tA tC(填“大于”、“小于’’或“等于")。
② 若A点时容器的体积为1 L,则该温度下B点的平衡常数 K= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中,已知含有H+、Mg2+、Al3+等阳离子,逐滴加入NaOH溶液发生反应。已知加入NaOH溶液的体积(x轴)和生成的沉淀质量(y轴)之间的关系,可用下图表示,则下列图中描述正确的是( )
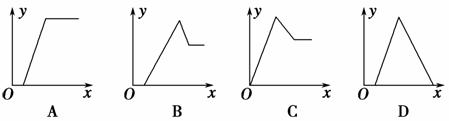
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素。在常温下A元素的单质是密度最小的气体,B元素的原子最外层电子数是其电子层数的3倍,C元素在同周期的主族元素中原子半径最大,D元素是地壳中含量最多的金属元素,E元素的单质是黄绿色的气体。下列说法正确的是( )
A.由元素A、B组成的化合物常温下一般是液态的
B.元素C、D的最高价氧化物对应的水化物之间不可能发生反应
C.由元素B、C、D组成的化合物可用作漂白剂
D.化合物AE与CE含有相同类型的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书正确的是
A.碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O
B.偏铝酸钠溶液中通入过量的二氧化碳气体:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32-
C.用稀硝酸浸泡做过银镜反应的试管:Ag+2H++NO3-=Ag++NO2↑+H2O
D.三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=Fe2++S↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
CH4是一种重要的化石燃料,在工农业生产中有着极其重要的应用。
(1)用甲烷可以消除氮氧化物的污染,其反应如下:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。在130℃和180℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g)。在130℃和180℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
| 实验编号 | 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
(1)130℃时,达到平衡状态时CH4的转化率为 。当温度为180℃、反应到40 min时,该反应 (填“是”或“否”)达到平衡,推断的依据是 。
(2)由表中数据分析可知,该反应的ΔH 0(填“=”、“﹥”或“﹤”),130℃和180℃平衡常数的关系:K(130℃) K(180℃)(填“=”、“﹥”或“﹤”)。
 (3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
①a电极上发生反应的电极反应式是 。
②电镀结束后,装置Ⅰ中溶液的pH (填“增大”、“减小”或“不变”)。
③若完全反应后,装置Ⅱ中Cu极质量减少12.8 g,则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
(4)用甲烷制取氢气的反应分为两步,其能量变化如下图所示:

写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com