
| A、pH相等的下列溶液①(NH4)2SO4、②NH4HSO4、③NH4Cl,c(NH4+)的大小关系为①=③>② |
| B、0.1mol/L的NaHA溶液,若pH=4,则溶液中存在:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| C、在NaHCO3和Na2CO3的混合溶液中一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
| D、在物质的量浓度之比为1:2的NaClO、NaHCO3的混合溶液中一定存在:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
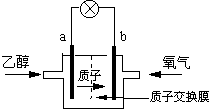 一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )
一种新型的乙醇电池,它用磺酸类质子溶剂.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图,下列说法正确的是( )| A、a极为电池的正极 |
| B、电池工作时电流由a极沿导线经灯泡再到b极 |
| C、电池负极的电极反应为:4H++O2+4e-=2H2O |
| D、电池工作时,1mol乙醇被氧化时就有12mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol苯分子含有3NA个C-C键 |
| B、一定条件下,1mol N2和3mol H2充分混合,反应后转移的电子数为6NA |
| C、常温下,78.0g Na2O2与58.5g NaCl所含阴离子数相等 |
| D、标准状况下,2.24L CCl4所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
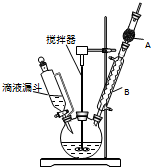 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.| 物质 | 沸点/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
| ①操作 |
| ②溶解、过滤 |
| ③洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
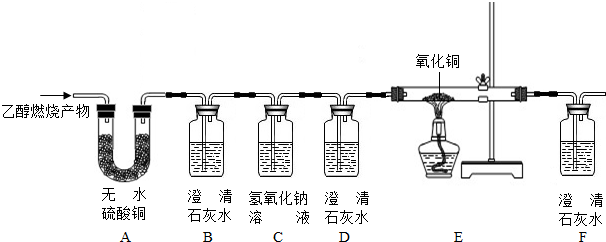
查看答案和解析>>
科目:高中化学 来源: 题型:
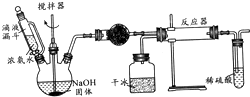 实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.
实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)?NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com