
����Ŀ�����ü�������������ȡ����Ӧ��ȡ����Ʒ����������ѳ�Ϊ��ʵ��ij��ѧ��ȤС����ʵ������ģ���������̣���Ӧ������������ը��������Ƶ�ģ��װ�����£�
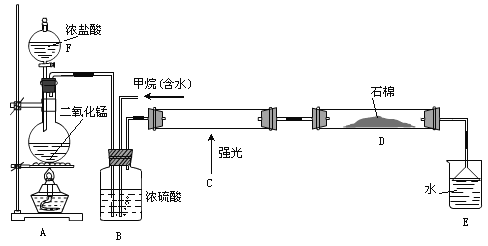
����Ҫ����գ�
��1������F������______________��A�з�Ӧ�����ӷ�Ӧ����ʽ___________________��
��2��Bװ�������ֹ��ܣ��ٿ��������ٶȣ��ھ��Ȼ�������______________________��
��3��Ϊ�˳������������Dװ���е�ʯ�������ȸ���KI��ĩ������Ϊ�ܷɼ�ʯ��______����ܡ����ܡ�����
��4��Eװ�õ�����________��
A.�ռ����� B.�������� C.��ֹ���� D.�����Ȼ���
��5��Eװ���г�������������,�������л���,��E�з�����������ѷ�����_____________________________��
���𰸡���Һ©��MnO2+4H++2Cl![]() Mn2++Cl2��+2H2O������鲻�ܣ����ɵ�HCl�ᱻ��ʯ������C��D��Һ
Mn2++Cl2��+2H2O������鲻�ܣ����ɵ�HCl�ᱻ��ʯ������C��D��Һ
��������
�ڼ��������£�Ũ����Ͷ������̷�Ӧ����������Ũ���������ˮ�ԣ��������������C�м���������ڹ��������·���ȡ����Ӧ�����ȴ�����HCl��D��ʯ����KI���⻯�غ�������Ӧ���ɵ���Ȼ��ƣ�β���к����Ȼ��⣬�Ȼ��⼫������ˮ������Eװ���������Ȼ��⣬���۵�©���ܷ��������ݴ˽��
��1������F������Ϊ��Һ©�������������£�Ũ����Ͷ������̷�Ӧ������������Ӧ�����ӷ���ʽΪMnO2+4H++2Cl![]() Mn2++Cl2��+2H2O��
Mn2++Cl2��+2H2O��
��2��Ũ���������ˮ�ԣ�����Bװ�õĹ��ܳ����������ٶ������Ȼ����������и����������á�
��3���������ɵ�HCl�ᱻ��ʯ�����գ�����Dװ���е�KI��ĩ���ܻ��ɼ�ʯ����
��4��E�������Ȼ������ܷ�ֹ����������Eװ�������������Ȼ���ͷ�ֹ������������ѡCD��
��5���ȴ�����������ˮ����HCl��������ˮ�����Բ��÷�Һ���������ᴿ��


 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������棨CeO2����һ����Ҫ��ϡ��������Է�̼�����Ҫ��CeFCO3��Ϊԭ���Ʊ�CeO2��һ�ֹ�������ͼ��ͼ��
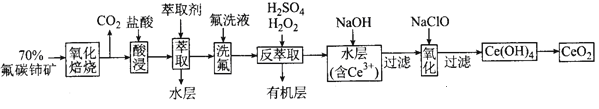
��֪����Ce4+������F-��ϳ�[CeFX]��4-x��+��Ҳ����SO42-��ϳ�[CeSO4]2+��
����������ϵ��Ce4+�ܱ���ȡ��[��HA��2]��ȡ����Ce3+���ܡ�
�ش��������⣺
��1��������������ǰ�轫��ʯ�����ϸ��������Ŀ����_____��
��2����������л������������ɫ���壬д��CeO2�����ᷴӦ�����ӷ���ʽ_____��Ϊ����������Ⱦ�������һ�ֽ��������_____��
��3������ȡ��ʱ���ڷ�Ӧ��Ce4++n��HA��2![]() Ce����H2n-4A2n��+4H+��ʵ��������ȡʱ�õ�����Ҫ������������Ϊ_____��
Ce����H2n-4A2n��+4H+��ʵ��������ȡʱ�õ�����Ҫ������������Ϊ_____��
��4��������ȡ���У���ϡ�����H2O2��������CeO2ת��ΪCe3+��H2O2�ڸ÷�Ӧ����_____������������������������������ԭ��������ÿ��1molH2O2�μӷ�Ӧ��ת�Ƶ������ʵ���Ϊ_____��
��5��������������Ļ�ѧ����ʽΪ_____��
��6��ȡ�������̵õ���CeO2��Ʒ0.50g���������ܽ����0.10mol/L FeSO4����Һ�ζ����յ�ʱ���汻��ԭΪCe3+���������ʾ����μӷ�Ӧ��������25.00mL����Һ���ò�Ʒ��CeO2����������Ϊ_____(Ce�����ԭ������Ϊ140)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��ԭ�ӵ��������1�����ӣ����Ԫ�ز�������
A.IA��Ԫ��B.����Ԫ��C.�ǽ���Ԫ��D.����Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ж��Ҵ�������ѻ�Ϊͬ���칹���������
A.�������Ƶ���������B.�������ƵĻ�ѧ����
C.���в�ͬ�ķ������D.����ʽ��ͬ����������ԭ�Ӽ�����ӷ�ʽ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȱ���Ⱦ�ϡ�ҽҩ��ҵ���������챽�ӡ������ȱ��������������ӵ��л��м��塣ʵ�������Ʊ��ȱ���װ������ͼ��ʾ(���мг�����������װ����ȥ)��
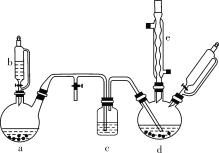
��ش��������⣺
(1)����b��������___������a��ʢ��KMnO4����������bʢ��Ũ���ᡣ������b�Ļ�����ʹŨ���Ỻ���������ɹ۲쵽����a�ڵ�������____�������ӷ���ʽ��ʾ�����������ԭ��_____
(2)����d��ʢ�б���FeCl3��ĩ����������a�����ɵ����徭������c��������d�С�����d�еķ�Ӧ���й������������¶���40��60 �棬�Լ��ٸ���Ӧ����������d�ļ��ȷ�ʽ�����_____���������ŵ���________________��
(3)�÷����Ʊ����ȱ��к��кܶ���������ҵ��������ͨ��ˮϴ��ȥFeCl3��HCl������Cl2��Ȼ��ͨ����ϴ��ȥCl2����ϴ��ͨ����Һ�õ����ȱ����л�������������ɷּ��е����±���ʾ��
�л��� | �� | �ȱ� | �ڶ��ȱ� | ����ȱ� | �Զ��ȱ� |
�е�/�� | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
�Ӹ��л����������ȡ�ȱ�ʱ����������ķ������ռ�____�����ҵ���֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10mL0.1mol��L��1CuCl2��Һ�е���0.1ml��L��1��Na2S��Һ���μӹ�������Һ�У�1gc(Cu2+)����˵�Na2S��Һ����ı仯��ͼ��ʾ������������ȷ����
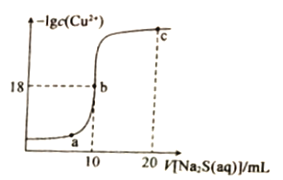
A. Na2S��Һ�У�c(S2��)+c(HS��)+c(H2S)==2c(Na+)
B. Ksp(CuS)��������Ϊ10��36
C. a��b��c������Һ�У�b��ˮ�ĵ���̶����
D. c����Һ�У�c(C1��)=2c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪij����ұ������ұ���ӹ��ļ������̡�
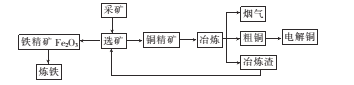
��֪�����С�ұ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪCu2S+O2 ![]() 2Cu+SO2
2Cu+SO2
(l)��ҵ��������Ҫ�豸��������¯�����豸������������Ҫ��Ӧ�Ļ�ѧ����ʽΪ________
(2)��ұ�������������еķ�����Ҫ�� ___���������Դ�����ʺͼ��ſ��ǣ��ɽ������������Ʊ�____��
(3)��ⷨ��ͭʱ�������� ___�����ͭ�塱��ͭ�塱������ͭ�к��еĽ����Ե�����ʽ�����ڵ���____��������������������IJ۵ף������ĵ缫��Ӧʽ��_____
(4)�ھ���ͭ�Ĺ����У��������Һ��c(Fe2+)��c(Zn2+)���������Ӱ���һ����⡣
��֪�������ʵ��ܶȻ�����(Ksp)���±���

���ڵ��Һ��pH�dz�ȥ�������ӵij��÷����������ϱ����ܶȻ������жϣ����е����ʵ���Ũ�ȵ�Fe2+��Zn2+��Fe3+��Cu2+����Һ������pH�����ߣ����ȳ���������������____��һ�ַ������ȼ��������H2O2���ٵ���pH��4���ҡ�����H2O2������Ӧ�����ӷ���ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ����ػ������ڻ��������ϵ��������Ź㷺��Ӧ�á��ش��������⣺
��1����̬Cuԭ���У��������ռ�ݵ�����ܲ�ķ�����___________��ռ�ݸ��ܲ���ӵĵ���_������ͼ��״Ϊ__________��Cu2+�۲���ӵĹ������ʽ(�����Ų�ͼ)Ϊ___________��
��2��Cu2O�۵�(1235��)��Cu2S�۵�(113��)�ߣ����Ǿ�����___________���壬ǰ���۵�ϸߵ�ԭ����_________________________________��
��3��Cu����N��S��O��Ԫ���γɻ����N��S��O����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ______________����Cu�Ĵ������£��Ҵ��ɱ�����Ϊ��ȩ����ȩ������̼ԭ�ӵ��ӻ���ʽ��________________��
��4��1mo[Cu(NH3)4]SO4�к��ЦҼ�����ĿΪ___________(��NA��ʾ�����ӵ�����)��
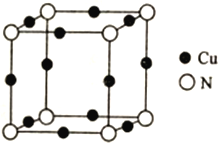
��5��Cu��N���γɵ�ij�־��������������ͼ��ʾ���侧������Ϊamm���þ���Ļ�ѧʽΪ___________��������ܶ�Ϊ___________g��cm��3(�г�����ʽ���ɣ���NA��ʾ�����ӵ�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�л���Ľṹ��ʽΪ![]() ���ж�����˵���в���ȷ����( )
���ж�����˵���в���ȷ����( )
A. ������ʹ����KMnO4��Һ��ɫ
B. ���ɷ���ȡ����Ӧ���ӳɷ�Ӧ���Ӿ۷�Ӧ��������Ӧ
C. 1mol���л��������������ӳɷ�Ӧ������������5mol����
D. ���л������ʽΪC14H17
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com