
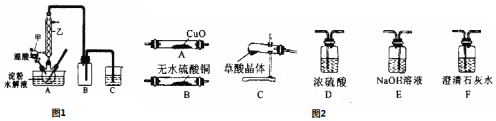
分析 (1)仪器甲的名称为分液漏斗;
(2)淀粉遇碘变蓝色,在已经水解的淀粉溶液中滴加几滴碘液,溶液显蓝色,则证明淀粉没有完全水解,溶液若不显色,则证明淀粉完全水解;
(3)检验H2O、CO和CO2气体,首先应该用无水硫酸铜遇水蒸气变蓝,再利用二氧化碳能使澄清的石灰水变浑浊,一氧化碳检验还原性,能还原黑色的氧化铜,生成的二氧化碳用澄清的石灰水检验,据此根据水蒸气、二氧化碳和一氧化碳的性质进行排序;
(4)根据A管质量减轻2.4g利用差量法计算出产生的一氧化碳的物质的量,再根据草酸晶体分解的方程式计算求得;
(5)根据草酸蒸气和二氧化碳的性质来回答.
解答 解:(1)仪器甲的名称为分液漏斗,故答案为:分液漏斗;
(2)淀粉遇碘变蓝色,在已经水解的淀粉溶液中滴加几滴碘液,溶液显蓝色,则证明淀粉没有完全水解,溶液若不显色,则证明淀粉完全水解,故答案为:碘水或I2;
(3)为证明草酸的受热分解产物中含有H2O、CO2和CO,先首先将混合气体通入无水硫酸铜检验水蒸气,如果变蓝说明有水蒸气产生,再通入澄清的石灰水检验二氧化碳,如果澄清的石灰水变浑浊,则证明含有二氧化碳气体,再用氢氧化钠溶液吸收二氧化碳,再通入澄清的石灰水检验二氧化碳是否被除尽,然后再将洗气后的气体进行干燥,最后将气体再通过黑色的氧化铜装置,一氧化碳和黑色的氧化铜反应生成铜和二氧化碳,再用澄清的石灰水检验二氧化碳是否存在,如果澄清石灰水变浑浊,则证明该混合气体中含有一氧化碳,故答案为:B; E; F;
(4)A管质量减轻2.4g,根据 CuO+CO$\frac{\underline{\;高温\;}}{\;}$Cu+CO2 △m
1 16
0.15mol 2.4g
再根据H2C2O4•2H2O=3H2O+CO+CO2,得分解的草酸晶体为0.15mol,所以质量为:0.15mol×126g/mol=18.9g,故答案为:18.9;
(5)草酸分解的气体中含有CO2,用氢氧化钠溶液会将二氧化碳除去,无法进行下一步检验,故B错,草酸既然是酸,那么就会跟碳酸根、碳酸氢根发生反应放出CO2,对检验CO2产生干扰,故A、C错,故选:D.
点评 本题考查了实验设计,计算等,难度较大,注意检验二氧化碳和一氧化碳的混合物中,要先检验二氧化碳再检验是否除尽最后再检验一氧化碳,为易错点.


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 500 ml,1mol/LFe2(SO4)3溶液和250mL 3mol/L的Na2SO4溶液所含硫酸根离子的物质的量浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2gNaHSO4晶体中阳离子和阴离子的总数为0.03NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中.Na+的物质的量浓度为lmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 涤纶、锦纶、蚕丝都属于合成纤维 | |
| B. | 塑料、液晶高分子和合成橡胶被称为三大合成材料 | |
| C. | 用于生产“尿不湿”的高吸水性树脂属于功能高分子材料 | |
| D. | 酚醛树脂是酚类物质和醛类物质加聚而成的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可以除去水中的悬浮颗粒等杂质,所以可以作净水剂 | |
| B. | 可用燃烧的方法鉴别羊毛围巾和合成纤维围巾 | |
| C. | 黄瓜含有丰富的维生素C,热锅爆炒可以减少维生素C的流失 | |
| D. | 石英玻璃纤维传导光的能力非常强,所以常用于制作光纤 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③ | C. | ②④ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com