
| A.H2与F2反应的热化学方程式为:H2(g)+F2(g)=2HF(g) ΔH=-541 kJ |
| B.44.8 L HF气体分解成22.4 L H2和22.4 L F2吸收541 kJ的热量 |
| C.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ |
| D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题

| A.△E1是该反应的活化能 |
| B.△E2是2mol HCl(g)的总键能 |
| C.该反应的热化学方程式为:H2(g)+Cl2(g)=2 HCl(g) △H=-183KJ/mol |
| D.该反应是一个吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,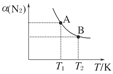
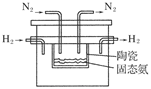
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.测定中和热的实验中每次实验需要测定三次温度数据 |
| B.化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C.凡经加热而发生的化学反应都是吸热反应 |
| D.反应物总能量和生成物总能量的相对大小决定了反应是放热还是吸热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 OH)3↓+( )H2Te↑
OH)3↓+( )H2Te↑查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在稀溶液中所有酸和碱反应的中和热数值都相等 |
| B.在稀溶液中HCl和NaOH反应和HNO3和KOH的中和热都相等 |
| C.在稀溶液中1mol酸和1mol碱反应放出的热量都相等 |
| D.将浓硫酸滴入氢氧化钠溶液中刚好生成1mol水时,产生的热量即为中和热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2SO2+O2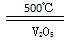 2SO3△H=-196.6kJ·mol-1 2SO3△H=-196.6kJ·mol-1 |
B.H2(g)+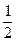 O2(g)====H2O(l)△H=-285.8kJ·mol-1 O2(g)====H2O(l)△H=-285.8kJ·mol-1 |
| C.2H2(g)+O2(g)====2H2O(l)△H=-571.6kJ |
| D.C(s)+O2(g)====CO2(g)△H=+393.5KJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 按要求书写热化学方程式:
按要求书写热化学方程式: g白色沉淀,写出表示丁烷燃烧热的热化学方程式
g白色沉淀,写出表示丁烷燃烧热的热化学方程式 O2(g)=2CO2(g)+2H2O(l) ΔH1=-87
O2(g)=2CO2(g)+2H2O(l) ΔH1=-87 0.3 kJ/mol
0.3 kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com