
 X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其申Y、W位 于同一主族,Z、W位于同一周期;Y的最外层电子数是K层电子数的3倍;Z是同一周期中金属性最强的元素,X的最外层电子数与Z相同,但X为非金属元素.请回答下列司题:
X、Y、Z、W为按原子序数由小到大排列的四种短周期的元素.其申Y、W位 于同一主族,Z、W位于同一周期;Y的最外层电子数是K层电子数的3倍;Z是同一周期中金属性最强的元素,X的最外层电子数与Z相同,但X为非金属元素.请回答下列司题: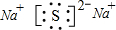 ,
,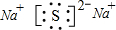 ;
;

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
| A、它们相差一个电子层 |
| B、它们的化学性质相似 |
| C、钾原子,钾离子均为同一元素 |
| D、灼烧时,它们的焰色反应都呈紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
129 53 |
127 53 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶液 | a | b | c | d | e |
| 化学式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com