
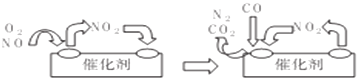
分析 (1)根据根据2NO+O2=2NO2,2NO2+4C0 $\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2,可得总反应;
(2)硝酸与NaOH等物质的量反应生成硝酸钠,根据氢氧化钠的物质的量求出硝酸的物质的量,由N原子守恒可以求出NOx的物质的量,再求出其体积和体积分数;
(3)根据原子守恒配平方程式,再根据体积比等于计量数之比求出x;
(4)根据二氧化碳气体体积和溶液质量增加的量列方程组解出一氧化氮和二氧化氮的体积,从而得出其体积之比.
解答 解:(1)①2NO+O2=2NO2 、②2NO2+4C0$\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2,①+②可得:2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2;
故答案为:2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$4CO2+N2;
(2)滴定时消耗浓度为cmol.L-1标准NaOH溶液amL,则氢氧化钠的物质的量为ca×10-3mol,则硝酸的物质的量为ca×10-3mol,由N原子守恒可以求出NOx的物质的量ca×10-3mol,则NOx的体积分数为$\frac{22.4×ac×1{0}^{-3}}{V}$=$\frac{22.4×ac×1{0}^{-3}}{V}$;
故答案为:$\frac{22.4×ac×1{0}^{-3}}{V}$;
(3)用氨可以和NOx在一定的条件下转化为N2和H20,若在标准状况下5L NOx与4L NH3恰好完全作用,其反应方程式为:NOx+$\frac{2x}{3}$NH3=$\frac{3+2x}{6}$N2+xH20,
由参加反应的气体的体积比等于计量数之比得5:4=1:$\frac{2x}{3}$,解得x=1.2;
故答案为:1.2;
(4)2NO2+Na2CO3=NaNO2+NaNO3+CO2,△m=48g;NO+NO2+Na2CO3=2NaNO3+CO2,△m=32g;结合反应方程式,知吸收NOx的物质的量为2mol,形成的钠盐中Na~N,同时产生1 mol CO2,0.5L 2mol/L的纯碱的物质的量是1mol,设NO的物质的量是x,NO2的物质的量是y,则x+$\frac{y-x}{2}$=1mol,32x+24(y-x)=44,解得:x=$\frac{1}{4}$mol,Y=$\frac{7}{4}$mol,即一氧化氮和二氧化氮的物质的量之比=1:7,所以相同条件下,二氧化氮和一氧化氮的体积之比是7:1,
故答案为:7:1.
点评 本题主要考查了氮氧化物相关知识、物质含量的测定、有关化学方程式的计算等,题目难度中等,侧重于考查学生对基础知识的应用能力和计算能力,掌握氮的氧化物的化学性质是解答的关键.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
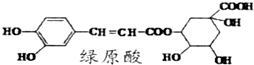
| A. | 分子中所有的碳原子均可能在同一平面内 | |
| B. | 绿原酸可以与FeCl3溶液发生显色反应 | |
| C. | 1 mol绿原酸与足量溴水反应,最多消耗2.5mol Br2 | |
| D. | 绿原酸不能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2 | B. | △H1<△H2 | C. | △H1=△H2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
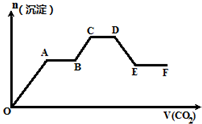 将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )
将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )| A. | O~A段反应的离子方程式是Ba2++CO32-═BaCO3↓ | |
| B. | A~B段反应的离子方程式是2OH-+CO2═CO${\;}_{3}^{2-}$+H2O | |
| C. | A~B段与C~D段所发生的反应相同 | |
| D. | D~E段沉淀的减少是由于碳酸钡固体与CO2的水溶液反应所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数 | B. | 中子数 | C. | 电子数 | D. | 原子序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
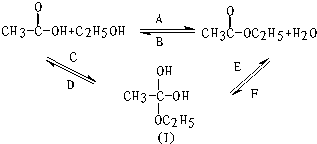 如图所示,乙酸跟乙醇在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B).反应可能经历了生成中间体(Ⅰ)这一步.
如图所示,乙酸跟乙醇在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B).反应可能经历了生成中间体(Ⅰ)这一步.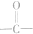 )或羟基基的氧原子用18O标记,则生成物水中前者没有、后者有(填“有”或“没有”)18O,作出上述判断的理由是羧酸分子中的羟基与醇分子中羟基的氢原子结合成水.
)或羟基基的氧原子用18O标记,则生成物水中前者没有、后者有(填“有”或“没有”)18O,作出上述判断的理由是羧酸分子中的羟基与醇分子中羟基的氢原子结合成水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
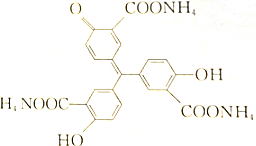 对于如图所示化合物,下列说法中错误的是( )
对于如图所示化合物,下列说法中错误的是( )| A. | 该化合物的化学式为C22H23O9N3 | |
| B. | 分子内已有3个羧基被氨中和,故完全反应1mol该化合物还需2molNaOH | |
| C. | 该化合物可与FeCl3发生显色反应,不与银氨溶液反应 | |
| D. | 每1mol该化合物可与5molBr2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com