
| A. | 1molNa2CO3约含有6.02×1023个Na2CO3分子 | |
| B. | 2molH2O的摩尔质量为36g/mol | |
| C. | 标准状况下,22.4LCH4含有的电子数为10NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
分析 A.碳酸钠为离子晶体;
B.摩尔质量与物质的量无关;
C.依据n=$\frac{V}{Vm}$,结合1个甲烷10个电子解答;
D.溶液体积未知.
解答 解:A.碳酸钠为离子晶体,不含分子,故A错误;
B.摩尔质量与物质的量无关,水的摩尔质量为18g/mol,故B错误;
C.标准状况下,22.4LCH4含有的电子数为$\frac{22.4L}{22.4L/mol}$×10×NA=10NA,故C正确;
D.依据n=CV可知,溶液体积未知无法计算溶液中微粒个数,故D错误;
故选:C.
点评 本题考查了物质的量相关概念及计算,明确摩尔质量、物质的量浓度定义,熟悉相关计算公式是解题关键题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 moI/L的CH3COOH溶液的pH=2.1 | |
| B. | 等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多 | |
| C. | 用CH3COOH溶液做导电实验,灯泡很暗 | |
| D. | 0.1 moI/L的CH3COOH溶液稀释100倍,pH<3. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO:0.001 mol•L-1 | B. | H2O:0.002 mol•L-1 | ||
| C. | NH3:0.002 mol•L-1 | D. | O2:0.001 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在银片上:2Ag+2H+═2Ag++H2↑ | |
| B. | 氧化铁与稀盐酸混合:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 碳酸钙溶于醋酸溶液中:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | NaHCO3溶液中加入 NaHSO4 溶液:HCO3-+HSO4-═CO2↑+H2O+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
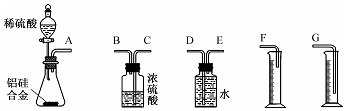
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铁与盐酸反应;有气泡逸出2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氢氧化钡溶液与稀硫酸反应;有白色沉淀生成Ba2++SO42-═BaSO4↓ | |
| C. | NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生 HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 碳酸镁与盐酸反应:有气泡逸出CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
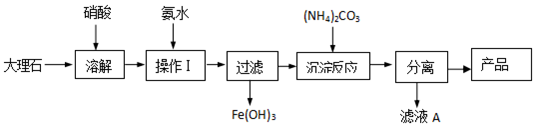
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.4mol/(L•s) | B. | v(C)=30mol/(L•min) | C. | v(A)=0.15mol/(L•s) | D. | v(B)=0.9mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2能使酸性KMnO4溶液、溴水、品红溶液褪色,且原理相同 | |
| B. | 不能用澄清石灰水鉴别SO2和CO2 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| D. | 少量SO2通过浓的CaCl2溶液能生成白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com