
分析 水能微弱电离出氢离子和氢氧根离子,在25℃时,水电离出的H+和OH-浓度均为10-7 mol/L,Kw=c(H+).c(OH-),离子积常数随温度变化,升温促进水的电离.
解答 解:H2O?H++OH-,水能微弱电离出H+、OH-,在25℃时,水电离出的H+和OH-浓度均为10-7 mol/L,Kw=c(H+).c(OH-)=10-7 mol/L×10-7 mol/L=10-14 (mol/L)2,水电离过程为吸热过程,升温促进电离平衡正向进行,氢离子浓度和氢氧根离子浓度都增大,离子积常数增大,
故答案为:10-7mol/L;增大;
点评 本题考查水的电离,侧重考查学生获取信息、分析学习能力,离子积常数只随温度变化.,题目难度不大


科目:高中化学 来源: 题型:实验题
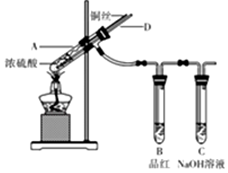 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验,实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
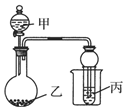 用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,能产生气体且丙中现象正确的是( )
用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,能产生气体且丙中现象正确的是( ) | 甲 | 乙 | 丙 | 试管中的现象 | |
| A | 浓氨水 | 生石灰 | Al(SO4)3溶液 | 先沉淀后消失 |
| B | 浓硫酸 | 亚硝酸钠 | 氢硫酸 | 溶液出现浑浊 |
| C | 浓硝酸 | 铜 | 淀粉KI溶液 | 试管口出现红棕色溶液仍为无色 |
| D | 浓盐酸 | 二氧化锰 | 含有KSCN的FeCl2溶液 | 溶液变红 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的NH4Cl溶液 | B. | pH=5的NaHSO4溶液 | ||
| C. | pH=5盐酸溶液 | D. | pH=8的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
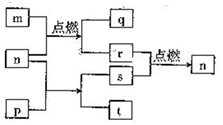 短周期主感元素X、Y、Z、W原子序数依次增大,W2+的电子层结构与氖相同,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种碱性氧化物,它们的关系如图所示( )
短周期主感元素X、Y、Z、W原子序数依次增大,W2+的电子层结构与氖相同,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种碱性氧化物,它们的关系如图所示( )| A. | Y、Z、W的简单离子半径:W>Z>Y | B. | 最高价氧化物的水化物的碱性:Z>W | ||
| C. | 简单气态氢化物的热稳定性:X>Y | D. | Y与Z形成的化合物中不含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液加热蒸干再灼烧后,固体为Al2O3 | |
| B. | 将水加热,KW增大,pH不变,仍呈中性 | |
| C. | 温度不变,向水中加入少量碳酸钠固体,KW增大 | |
| D. | 向0.01 mol•L-1醋酸溶液中加水,溶液PH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
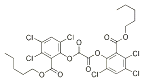 草酸二酯是荧光棒成分,发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯结构简式如图所示. 下列有关说法不正确的是( )
草酸二酯是荧光棒成分,发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯结构简式如图所示. 下列有关说法不正确的是( )| A. | 草酸二酯的分子含两种官能团 | |
| B. | 草酸二酯属于芳香族化合物 | |
| C. | 草酸二酯中苯环上氢原子被一个溴原子取代的产物只有一种 | |
| D. | 1mol草酸二酯与氢氧化钠溶液反应最多消耗4molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com