
【题目】过氧化氢分解反应过程中,能量变化如图所示:下列说法正确的是

A. 催化剂可以改变过氧化氢分解反应的焓变
B. CuCl2或FeCl3可以催化H2O2分解反应
C. 催化剂不能改变反应路径
D. H2O2分解是吸热反应
【答案】B
【解析】
A.催化剂不能改变反应的焓变;
B. CuCl2或FeCl3是H2O2分解反应的催化剂;
C.催化剂能够降低化学反应的活化能,改变了反应路径;
D.由图可知,H2O2分解是放热反应;
A.反应的焓变,只与反应的始态和终态有关,而与变化路径无关,催化剂能降低反应所需的活化能,但不能改变反应的焓变,故A项错误;
B.CuCl2或FeCl3、过氧化氢酶等都可以催化H2O2分解反应,故B项正确;
C.由图可知,催化剂通过改变反应的途径降低了反应的活化能,故C项错误;
D.由坐标图可知,过氧化氢分解的反应中,反应物的总能量高于生成物的总能量,该反应为放热反应,故D项错误;
综上,本题选B。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是

A. 甲用于实验室制取少量CO2 B. 乙用于配制一定物质的量浓度的硫酸
C. 丙用于模拟生铁的电化学腐蚀 D. 丁用于蒸干A1Cl3溶液制备无水AlC13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2===2H2O,下列有关说法正确的是( )
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-===4OH-
C. 每转移0.1 mol电子,消耗标准状况下1.12 L的H2
D. H+由b极通过固体酸电解质传递到a极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.⑴指出如下图实验装置中的错误之处(加热装置中烧杯底部已垫有石棉网)
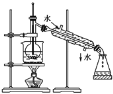
①____________________;
②____________________。
⑵图是某学生的过滤操作示意图,其操作不规范的是______

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
Ⅱ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请回答下列问题:


⑴指出提取碘的过程中有关实验操作①和②的名称:__________;________。
⑵在3 mL含碘的水溶液中加入1mL四氯化碳,振荡静置后观察到试管里的分层现象是上图中的_____(注:试管中深色区为有色溶液),上层无色溶液的溶质是_____下层颜色是_____。
⑶从含碘的有机溶液中提取碘和回收有机溶剂,还需经过的操作是_______。
Ⅲ.某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:

欲证明滤液中存在SO42-、OH-,选用的方案是先取少量的滤液滴加________,发现溶液变红,再向其中加入________溶液,出现白色沉淀,则可证明SO42-、OH-,均存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医学上被广泛应用于X射线造影剂、甲状腺癌防治等方面。实验室可用铁屑还原法制碘化钠。回答下列问题:
(1)向反应容器中加入30mL40%的NaOH溶液、25.4gI2,搅拌并加热,发生反应:3I2+6NaOH![]() 5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是___________,若温度过高产生的影响是______________________。
5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是___________,若温度过高产生的影响是______________________。
(2)已知:IO3-+5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性。某同学设计如下方案,检验反应后溶液中存在IO3-,且c(OH-)>c(H+)限选试剂及用品:1 mol·L-1H2SO4、2 mol·L-1HNO3、淀粉KI试纸、红色石蕊试纸、蓝色石蕊试纸
实验操作 | 实验现象 | 结论 |
①用玻璃棒蘸取溶液,点在___试纸上 | 试纸呈蓝色 | c(OH-)>c(H+) |
②用玻璃棒蘸取溶液,点在___试纸上 | 试纸不变色 | |
③向实验②的试纸上滴加____溶液 | 试纸呈蓝色 | 溶液中有IO3- |
(3)向反应后的溶液中加入铁粉,产生红褐色沉淀,则该反应的离子方程式为___________。充分反应后,从混合物中获得NaI固体,首先应进行___________(填操作名称),若后续操作中直接蒸发结晶往往得不到较纯的NaI固体,可能的原因是___________。为将溶液中的NaIO3全部还原成NaI,投入铁屑的质量不少于___________g(精确到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早发现并广泛使用的一种金属。向硫酸铜溶液中逐滴滴加稀氨水,产生蓝色沉淀:继续滴加稀氨水,沉淀溶解,溶液最终变为深蓝色:再向深蓝色溶液中加入无水乙醇,析出[Cu(NH3)4]SO4·H2O。回答下列问题:
(1)基态Cu原子中,电子在核外排布的原子轨道共有________个。
(2)N、O、S元素的原子对键合电子吸引力最大的是_________。
(3)[Cu(NH3)4]2+中,提供孤对电子的是________。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是________(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是________。
(4)NH3中N原子的杂化方式是_________,乙醇分子中采用同样杂化方式的原子有_________________个。
(5)硫元素对应的含氧酸酸性是H2SO4强于H2SO3,其原因为_________。

(6)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为_________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:
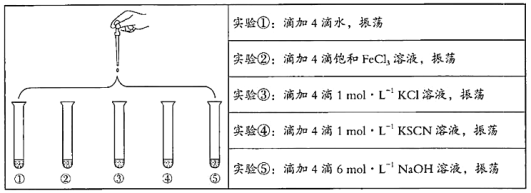
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为 283 kJ
B.反应①正反应活化能与逆反应活化能之差为+566 kJ/mol
C.反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com