【答案】
分析:(1)依据四个反应的特征,从结合氢离子,结合水中的氢分析判断;
(2)根据题给条件厉害书写热化学方程式的原则写出;
(3)依据(2)中写出的热化学方程式和H
2O(1)=H
2O(g)△H=+44kJ/mol,利用盖斯定律写出热化学方程式计算;
(4)依据反应产物的性质分析无污染物产生分析;
(5)依据反应物和物质的量之比结合氧化还原反应的电子守恒和原子守恒写出化学方程式.
解答:解:(1)A、依据反应N
2H
4+H
3O
+═N
2H
5++H
2O 实质是肼结合氢离子反应证明肼具有碱性,故A错误;
B、依据反应N
2H
4+H
2O?N
2H
5++OH
-,N
2H
5++H
2O?N
2H
62++OH
-说明肼结合水中的氢离子发生了电离生成了氢氧根离子,故B错误;
C、肼结合水中的氢离子发生了电离生成了氢氧根离子,溶液显碱性且能发生两步电离,证明肼是二元弱碱;故C正确;
D、肼分子结合水中的氢离子发生了电离生成了氢氧根离子,属于二元碱,故D错误;
故答案为:C;
(2)已知0.4mol液态肼和足量H
2O
2(l)反应生成氮气和水蒸气时放出256.64kJ的热量,依据热化学方程式的书写原则,结合定量关系写出,1mol肼和过氧化氢反应生成氮气和水蒸气放出的热量=
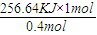
=641.6KJ,所以热化学方程式为:N
2H
4(1)+2H
2O
2(1)=N
2(g)+4H
2O(g)△H=-641.6kJ/mol,
故答案为:N
2H
4(1)+2H
2O
2(1)=N
2(g)+4H
2O(g)△H=-641.6kJ/mol;
(3)16g液态肼物质的量=
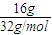
=0.5mol,
由①N
2H
4(1)+2H
2O
2(1)=N
2(g)+4H
2O(g);△H=-641.6kJ/mol;
②H
2O(1)=H
2O(g)△H=+44kJ/mol,
结合盖斯定律的内容和要求,可以把②×4方向倒转得到③4H
2O(g)=4H
2O(l)△H=-44×4kJ/mol=-176kJ/mol,
①+③得到N
2H
4(1)+2H
2O
2(1)=N
2(g)+4H
2O(l);△H=-817.6kJ/mol,
所以0.55mol液态肼与足量双氧水反应生成氮气和液态水时,放出的热量=
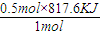
=408.8KJ,
故答案为:408.8KJ;
(4)反应应用于火箭推进器,除释放出大量热量和快速生成大量气体产生巨大推力外,反应的生成物是氮气和水,很突出的优点是对环境无污染;
故答案为:产物为氮气和水,无污染;
(5)氨和次氯酸钠按物质的量之比2:1混合可生成肼,依据反应物和产物肼可知,该反应为氧化还原反应,依据化合价的变化氨气中的氮元素化合价从-3价升高到-2价,次氯酸钠做氧化剂,氯元素化合价从+1价降低到-1价,结合氨和次氯酸钠按物质的量之比2:1混合可生成肼和原子守恒、转移电子守恒,化学方程式为2NH
3+NaClO=N
2H
4+NaCl+H
2O,还原产物为NaCl,
故答案为:2NH
3+NaClO=N
2H
4+NaCl+H
2O;NaCl.
点评:本题考查了有关肼的结构和性质,利用信息的推断能力,热化学方程式的书写与计算,盖斯定律的应用,反应产物的分析,氧化还原反应的原理应用.

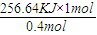 =641.6KJ,所以热化学方程式为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.6kJ/mol,
=641.6KJ,所以热化学方程式为:N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)△H=-641.6kJ/mol,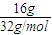 =0.5mol,
=0.5mol,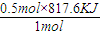 =408.8KJ,
=408.8KJ,

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案