
A.5×10-13 mol·L-1 B.0.02 mol·L
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:阅读理解
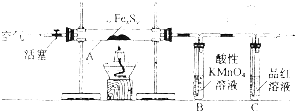
| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0 (另加少量可溶于水MnSO4粉末) |
2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:2010—2011学年广东省梅州市曾宪梓中学高二上学期期末考试理综)化学部分 题型:填空题
(16分)
(1)下列有关实验操作或结果的说法中错误的是
A.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
B.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
(2)氢氧化铝的酸式电离方程式:
(3)向明矾溶液中逐滴加入氢氧化钡溶液至铝离子刚好沉淀完全时,离子反应总方程式为:
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失), 和 两种粒子的物质的量之和比OH―多0.05mol。
查看答案和解析>>
科目:高中化学 来源:2013届吉林省高二上学期期末考试化学试卷 题型:填空题
(12分)某化学反应2A  B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
若实验操作、数据记录均是正确的,试分析数据回答下列问题:
|
实验 序号 |
时 间 浓度 温度 |
0 |
10
|
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1) 在实验1,反应在10至20分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是________反应(选填吸热、放热)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com