
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=Z+A |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |
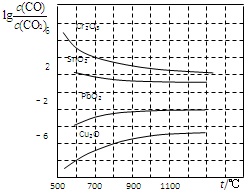
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X元素原子的半径一定小于Y元素原子的半径 | |
| B. | Y元素的氧化物不可能与X元素的气态氢化物反应 | |
| C. | X元素与氢元素形成的化合物中一定不含非极性键 | |
| D. | Y元素与X元素原子的最外层电子数一定不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 温度T/℃ | A溶液 | B溶液 |
| ① | 30 | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20 | 20mL0.1mol•L-1H2S2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
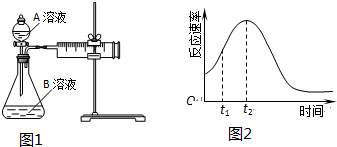
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | H2SO4既不是氧化剂又不是还原剂 | |
| D. | 1 mol KClO3参加反应时有10 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
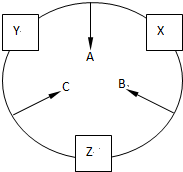 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.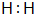
 NH4++OH-.
NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8+$\frac{1}{2}$ lg2 | B. | 9+lg2 | C. | 10+$\frac{1}{2}$ lg2 | D. | 11+2lg2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(CH3COO-)<c(Na+) | B. | c(CH3COOH)+c(CH3COO-)=0.2mol/L | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COO-)>c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com