
设NA为阿伏加德罗常数的值,下列说法正确的是
A.32 g O2所含的原子数目为NA
B.0.5 mol H2SO4含有的原子数目为3.5NA
C.HNO3的摩尔质量是63 g
D.0.5NA个氯气(Cl2)分子的物质的量是1 mol
科目:高中化学 来源:2016届江西省九江市七校高三第一次联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.相同体积和物质的量浓度的不同溶液里所含溶质的物质的量相同。
B.10 mol/L的浓盐酸与H2O等质量混合所得混合液的浓度为5 mol/L。
C.溶液中溶质质量分数为w,密度为ρ g/cm3,溶质摩尔质量为M g/mol的溶液的物质的量浓度为 mol/L。
mol/L。
D.一定物质的量浓度的溶液配制过程中,仰视定容,所得溶液的浓度偏大。
查看答案和解析>>
科目:高中化学 来源:2016届福建省福州市高三上学期第二次质量检测考试化学试卷(解析版) 题型:选择题
下列有关性质的比较,不能用元素周期律解释的是
A.酸性:H2SO4>H3PO4 B.非金属性:Cl>Br
C.碱性:NaOH>Mg(OH)2 D.热稳定性:Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二第一学期第一次月考化学试卷(解析版) 题型:选择题
根据元素周期律和物质结构的有关知识,以下有关排序错误的是( )
A.离子半径:S2->Cl->Ca2+ B.原子半径:Ca>S>Cl
C.热稳定性:HCl>H2S>H2Se D.酸性:HClO4<HBrO4<HIO4
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:实验题
(18分)1000mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(所加试剂均过量):
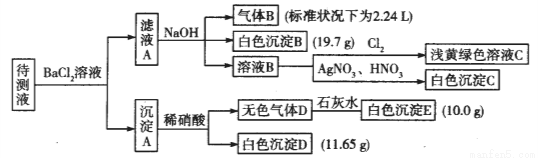
(1)写出生成白色沉淀B的离子方程式:_______________。
(2)待测液中肯定不存在的阳离子是_____________。
(3)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
浓度/ mol·L-1 |
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:__________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是__________。
②沉淀A中能还原稀硝酸的成分是________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源:2016届河北省冀州市高三复习班上第一次月考化学试卷A(解析版) 题型:实验题
(10分)某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用,实验过程如下:
过程Ⅰ:
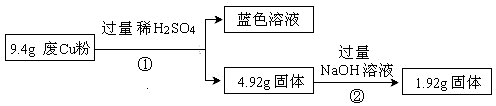
(1)废Cu粉中一定含有的杂质是 (填化学式)。
(2)写出过程②发生反应的离子方程式: 。
过程Ⅱ:
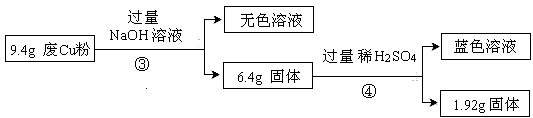
(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是 (化为最简整数比)
过程Ⅲ:已知25℃时:
电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶度积(Ksp) | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
(4)在Ⅱ中所得蓝色溶液中加入一定量的H2O2 溶液,调节溶液的pH范围为 ,然后过滤、结晶,可得CuSO4·5H2O。
(5)下列与 Ⅲ方案 相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+ 氧化为Fe3+ 的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目:高中化学 来源:2016届安徽省合肥市高三上第二次段考化学试卷(解析版) 题型:实验题
(11分)硫酸锰可作为饲料添加剂用于增肥,也可用于某些化学反应的催化剂,易溶于水,不溶于乙醇。工业上常用软锰矿(主要成分为MnO2,含有MgSO4等杂质)制备硫酸锰,其简化流程如下:
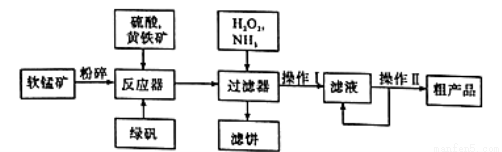
(1)为了加快软锰矿与硫酸、黄铁矿反应的速率,工业上除采用粉碎软锰矿的方法,还可以用哪些方法 (写两种)。
(2)流程中黄铁矿(主要含FeS2)和FeSO4的作用都是作还原剂,请写出FeSO4与软锰矿反应的离子方程式 。
(3)双氧水和氨水的作用分别是 .
(4)操作II包括 、 、 、洗涤、干燥,可制得MnSO4·H2 O粗产品.洗涤中最好选用 ’
A.稀硫酸 B.水 C.乙醇 D.浓硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年海南华侨中学高三第一次模拟考试化学试卷(解析版) 题型:选择题
下列表述不正确的是
A | B | C | D |
|
|
|
|
盐桥中的Cl-移向CuSO4溶液 | a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 | 粗铜的电极反应式为:Cu2++2e-=Cu | 正极反应式为:O2+4e-+2H2O=4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com