
现有一包铝热剂是铝粉和氧化铁(Fe2O3)粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(假定反应前后溶液的体积不变):
①向其中一份固体中加入100 mL 2.0mol?L-1的NaOH溶液,加热使其充分反应后过滤,测得溶液中的c(OH-)=1mol?L-1
②向另一份固体中加入100 mL 4.0 mol?L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且c(H+)=0.1mol?L-1则产生的气体的体积(标准状况)为 ( )
A.2.856L B.2.448L C.2.688L D.2.352L
A
【解析】
试题分析:在第一份中,根据反应方程式可知:2Al+2OH-+2H2O=2AlO2-+3H2↑ n(Al)=n(OH-) =0.1L×1mol/L=0.1mol;在另一份溶液中,根据电荷守恒可得:2n(Fe2+)+3n(Al3+) +n(H+)=n(Cl-)。2n(Fe2+) +3×0.1+0.1×0.1=0.1×4,解得n(Fe2+)=0.095mol。Al失去的电子与Fe3+、H+得到的电子的物质的量相等,所以H+得到的电子产生氢气的物质的量是:(0.1×3-0.045)÷2mol=0.1275mol. 则产生的气体在标准状况下的体积为0.1275mol×22.4L/mol=2.856L 。因此选项是A。
考点:考查元素及化合物的性质、守恒法在化学计算中的应用的知识。


科目:高中化学 来源:2013-2014河南省周口市高一下学期6月联考化学试卷(解析版) 题型:填空题
(10分)化学在生活中有很多的应用,如臭氧可用于空气净化、饮用水消毒、工业废物处理和作为漂白剂等,氮化硅(Si3N4)是一种新型陶瓷材料,具有较高的硬度且耐高温。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。已知: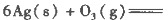
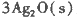 反应生成3 mol Ag2O(s)时放出的热量为
反应生成3 mol Ag2O(s)时放出的热量为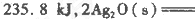
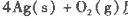 反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
(2)氮化硅()可由石英与焦炭在高温的氯气流中通过如下反应制得:
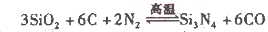
在VL的密闭容器中进行反应,实验数据如下表:

①实验l和实验2表明,________对反应速率有影响,对同一规律研究的实验还有一组是________(填实验序号)。本实验还研究了_______对反应速率的影响。。
②实验5中,t1________(填“>”、“<”或“=”)120,平衡时,二氧化硅的转化率为____________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省周口市高一下学期5月联考化学试卷(解析版) 题型:选择题
下列与化学有关的表述正确的是
A.生物质能源是可再生能源,缺点是严重污染环境
B.“春蚕到死丝方尽,蜡烛成灰泪始干”其中的“丝”和“泪”化学成分都是蛋白质
C.对“地沟油”进行分馏可以得到汽油
D.可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高二期终质量评估化学试卷(解析版) 题型:选择题
有机物A的分子式为C11H16 ,它不能因反应而使溴水褪色,但能使酸性KMnO4溶液褪色,经测定数据表明,分子中除含苯环外不再含有其他环状结构,且苯环上只有一个侧链,符合此条件的烃的结构有
A.5种 B.6种 C.7种 D.8种
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:填空题
(14分)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用下图A装置制备乙酸乙酯.
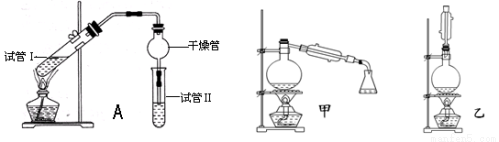
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:
与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是 .
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的厚度/cm |
A | 2mL乙醇、1mL乙酸、 | 饱和Na2CO3溶液 | 3.0 |
B | 2mL乙醇、1mL乙酸 | 0.1 | |
C | 2mL乙醇、1mL乙酸、 | 0.6 | |
D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是 mL和 mol?L-1.
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.
(3)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为 .
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图.图中( )内为适当的试剂,【 】内为适当的分离方法.
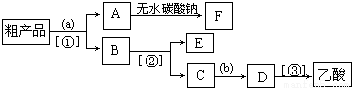
①试剂a是 ;分离方法②是 ,分离方法③是 .分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后 (填标号),
A.直接将乙酸乙酯从分液漏斗上口倒出
B.直接将乙酸乙酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸乙酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出
②在得到的A中加入无水碳酸钠粉末,振荡,目的是 .
(5)为充分利用反应物,甲、乙两位同学分别设计了上面图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为最合理的是
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:选择题
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应A(s)+2B(g)  C(g)+D(g)已达到平衡状态①各气体物质的物质的量浓度②气体的总物质的量③混合气体的压强④混合气体的密度
C(g)+D(g)已达到平衡状态①各气体物质的物质的量浓度②气体的总物质的量③混合气体的压强④混合气体的密度
A.只有①② B.只有①④ C.只有①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:选择题
下表物质与其所含化学键类型、所属化合物类型完全正确的一组是
选 项 | A | B | C | D |
物 质 | CO2 | MgCl2 | HCl | NaOH |
所含化学键类型 | 共价键 | 离子键、共价键 | 离子键 | 离子键、共价键 |
所属化合物类型 | 共价化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
查看答案和解析>>
科目:高中化学 来源:2013-2014河南师大附中高三4月份月考理综化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构和性质】(15分)
元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一价离子也可形成负一价离子。请回答下列问题:
(1)Y元素原子的价层电子的轨道表示式为______________,该元素的名称是_____;
(2)在X与Z形成的化合物XZ3中,X的杂化类型是 ,该化合物的空间构型为_____________;短周期元素形成的化合物中与XZ3互为等电子体的是 ;
(3)请写出X的两种含氧酸的化学式 、 ,其中酸性较强的是 。
(4)Q与Z同主族。Q单质的晶胞如下图所示,若设该晶胞的密度为ag/cm3,阿伏加德罗常数为NA,Q原子的摩尔质量为M,则表示Q原子半径的计算式为 。

查看答案和解析>>
科目:高中化学 来源:2013-2014河北省高二下学期第三次月考化学试卷(解析版) 题型:选择题
使同质量的四种物质:①淀粉②环己烷 ③乙炔 ④甲酸甲酯分别在过量氧气中完全燃烧,其消耗氧气量由多到少的次序排列正确的是( )
A.②>③>①>④ B.②>③>④>① C.①=④>②>③ D.②>③>①=④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com