
| A. | 过量的氢气与氮气 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18 mol/L硫酸 |
分析 A.合成氨是一个可逆反应,不能朝一个方向进行到底;
B.二氧化锰只与浓盐酸反应,稀盐酸不反应,过量浓盐酸和二氧化锰反应二氧化锰可以完全反应;
C.铜活泼性弱只能与浓硫酸反应,与稀硫酸不反应;
D.过量的锌与18mol/L硫酸溶液反应,首先生成二氧化硫,当浓变稀的时候生成氢气.
解答 解:A.合成氨是一个可逆反应,无论如何充分反应,都不能完全反应而达到百分之百,故A正确;
B.二氧化锰只与浓盐酸反应,稀盐酸不反应,二氧化锰过量,稀盐酸也不能完全反应,若浓盐酸过量,二氧化锰可以完全反应,故B错误;
C.铜活泼性弱只能与浓硫酸反应,与稀硫酸不反应,故C正确;
D.过量的锌与18mol/L硫酸溶液反应,首先生成二氧化硫,当浓变稀的时候生成氢气,故D错误;
故选AC.
点评 本题考查物质的性质,题目难度不大,注意化学反应中的一些特殊情况,注意反应的可逆性和物质的浓度问题.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
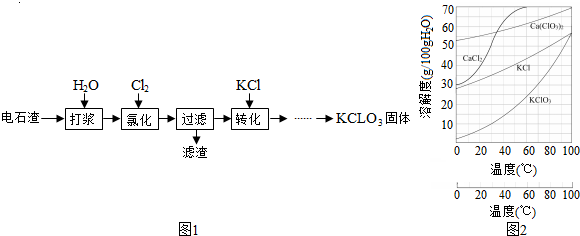
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径最大的主族元素是④ | B. | 电负性最大的元素是① | ||
| C. | 第一电离能最小的元素是② | D. | ③的最高正化合价一定是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
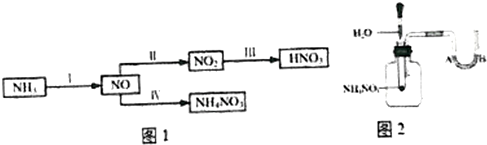
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com