
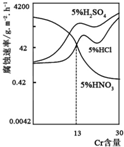
 如图是三种酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )
如图是三种酸对Fe-Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )| A、稀硫酸对Fe-Cr合金的腐蚀性比稀硝酸和稀盐酸都强 |
| B、随着Fe含量的增加,Fe-Cr合金在5%HNO3中的耐腐蚀性越来越弱 |
| C、Cr含量等于13%时,三种酸对Fe-Cr合金的腐蚀速率由快到慢的顺序为H2SO4>HCl>HNO3 |
| D、Cr含量小于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 |


 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
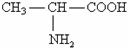 ,则下列说法不正确的是( )
,则下列说法不正确的是( )A、丙氨酸与氢氧化钠溶液反应生成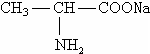 |
B、丙氨酸与盐酸反应生成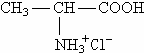 |
C、丙氨酸分子间发生成肽反应生成二肽的结构为 |
| D、丙氨酸不属于a-氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.3 mol?(L?min)-1 |
| B、0.6mol?(L?min)-1 |
| C、0.2 mol?(L?min)-1 |
| D、0.1 mol?(L?min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
| ||||
B、电解饱和氯化铝溶液:2Cl-+2H2O
| ||||
C、实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-
| ||||
| D、向 NaHS 溶液中通入适量氯气:HS-+Cl2═S↓+H++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属的颜色和熔沸点 |
| B、金属元素的最高价氧化物对应的水化物的碱性强弱 |
| C、1mo金属单质在反应中失去电子的多少 |
| D、金属元素的单质和水或酸置换出氢的难易 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过滤时,漏斗下端管口与烧杯内壁 |
| B、使用胶头滴管时,尖嘴与试管内壁 |
| C、过滤时,盛被过滤液体的烧杯口与玻璃棒 |
| D、向试管倾倒液体药品时,试剂瓶口与试管口 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com