保持洁净安全的生存环境已成为全人类的共识.
(1)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量.为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行______处理.为治理汽车尾气中NO和CO的排放,在汽车的排气管上安装催化净化装置,使NO和CO转化为无毒气体,该反应的化学方程式为______ N2+2CO2
【答案】
分析:(1)化石燃料会产生大量的二氧化碳,还会产生二氧化硫;反应物、生成物和反应条件及质量守恒定律写出正确的化学方程式;
(2)①根据化学方程式进行计算;
②根据题干信息可知:反应物是NO
2-和NH
4+,有N
2生成,反应中只有氮元素发生变价,结合质量守恒定律可知:生成物还有H
2O,然后进行配平即可,注意反应条件;
(3)①根据题目信息来计算;
②根据吸收后烟气总体积减小,NO
x含量仍超过400 mg/m
3来分析
解答:解:(1)化石燃料会产生大量的二氧化碳,还会产生二氧化硫,为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行脱硫,故答案为:脱硫;
CO与NO反应生成的是N
2和CO
2:2CO+2NO
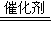
2CO
2+N
2,故答案为:2CO+2NO
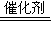
2CO
2+N
2;
(2)①由2NH
4++3O
2═2HNO
2+2H
2O+2H
+和2HNO
2+O
2═2HNO
3得
2NH
4++4O
2═2HNO
3+2H
2O+2H
+ 36 128
1g 4.57g
故氨态氮元素1g转化为硝酸态氮(硝酸态氮以HNO
3表示)时需氧气的质量为4.57g,故答案为:4.57;
②反应物是NO
2-和NH
4+,生成物还有H
2O,N
2,反应的化学方程式为:NH
4++NO
2-
N
2↑+2H
2O,故答案为:NH
4++NO
2-
N
2↑+2H
2O;
(3)①1m
3烟气中最高允许含NO的质量为:400mg×0.85=340mg=0.34g,体积为:
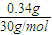
×22.4L/mol=0.25L,故答案为:0.25;
②1m
3含2000mg NO
x的烟气被吸收,若吸收率为80%,则剩余的NO
x为400mg,因吸收后烟气总体积减小,NO
x含量仍超过400 mg/m
3,故答案为:不符合;吸收后烟气总体积减小,NO
x含量仍超过400 mg/m
3;
点评:本题是道综合题,涉及到的知识点较多,注意基础知识的积累.

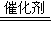 2CO2+N2,故答案为:2CO+2NO
2CO2+N2,故答案为:2CO+2NO 2CO2+N2;
2CO2+N2; N2↑+2H2O,故答案为:NH4++NO2-
N2↑+2H2O,故答案为:NH4++NO2- N2↑+2H2O;
N2↑+2H2O;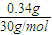 ×22.4L/mol=0.25L,故答案为:0.25;
×22.4L/mol=0.25L,故答案为:0.25;


 )可导致患者出现头痛、恶心等病状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式:
)可导致患者出现头痛、恶心等病状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式:
