
| A. | 石油的分馏 | B. | 石油裂化 | C. | 石油裂解 | D. | 煤的干馏 |
分析 分馏是物理变化,所以分子总数基本不变;而热裂化、裂解的原理与裂化相同,均将较长碳链的烃在高温下发生反应生成短碳链烃的过程,所以分子数必定增加,以此来解答.
解答 解:A.分馏是物理变化,所以分子总数基本不变,故A正确;
B.裂化将较长碳链的烃在高温下发生反应生成短碳链烃的过程,所以分子数必定增加,故B错误;
C.裂解的原理与裂化相同,所以分子数也会增加,故C错误;
D.煤的干馏发生复杂的物理、化学变化,生成粗苯、煤焦油等,分子数增多,故D错误.
故选A.
点评 本题综合考查化学反应,侧重考查石油与煤的综合利用,为高频考点,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:向饱和氯化铁溶液中滴加氨水 | |
| B. | 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 | |
| C. | 检验食盐中是否含有KIO3:取少量食盐溶液,加稀硫酸酸化,再滴入淀粉溶液,观察实验现象 | |
| D. | 证明在相同温度下Ksp[Mg(OH)2]>Ksp[Fe(OH)3]:向10mL0.2 mol•L-1NaOH溶液中滴入2滴0.1 mol•L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol•L-1 FeCl3溶液,观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,含有6.02×1024个电子的重水(D2O)的质量约为18g | |
| B. | 常温下,0.5molAl与足量的盐酸反应,转移的电子数约为9.03×1022 | |
| C. | 标况下,17g NH3和22.4LH2O含有相同的电子数 | |
| D. | 50mL0.5mol/L Na2SO4溶液中所含的Na+数目和0.005mol F_所含电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
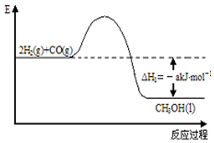 能源是人类生存和发展的重要支柱.研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-b kJ•mol-1,CH3OH的燃烧热
能源是人类生存和发展的重要支柱.研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-b kJ•mol-1,CH3OH的燃烧热 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相等 | B. | 前者比后者大3倍 | ||
| C. | 后者是前者的1011倍 | D. | 后者是前者的108倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应是吸热反应 | |
| B. | 断裂 1 mol A-A 键和 1 mol B-B 键放出 x kJ 的能量 | |
| C. | 断裂 2 mol A-B 键需要吸收 y kJ 的能量 | |
| D. | 2 mol AB 的总能量大于1 mol A2 和 1 mol B2 的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相关反应 | 反应热 | 平衡常数 |
| FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| $\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$Fe(s)+H2S(g) | △H2 | K2 |
| FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com