
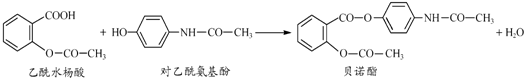
 .
. ,请写出两步反应中依次
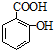
,请写出两步反应中依次分析 (1)根据贝诺酯的结构简式可知其分子式;
(2)酚羟基易被空气中的氧气氧化;
(3)乙酰水杨酸中没有酚羟基,不能与溴反应,对乙酰氨基酚中有酚羟基,能与浓溴水反应使溴水褪色;
(4)乙酰水杨酸与足量氢氧化钠溶液反应,羧基被中和,酯基水解生成酚钠和羧钠;
(5)乙酰水杨酸制备 ,可将先碱性水解得
,可将先碱性水解得 ,
, 再酸化可得
再酸化可得 ,据此答题;
,据此答题;
解答 解:(1)根据贝诺酯的结构简式可知其分子式为C17H15NO5,
故答案为:C17H15NO5;
(2)对乙酰氨基酚分子中的酚羟基易被空气中的氧气氧化,所以对乙酰氨基酚在空气易变质,
故答案为:对乙酰氨基酚分子中的酚羟基易被空气中的氧气氧化;
(3)乙酰水杨酸中没有酚羟基,不能与溴反应,对乙酰氨基酚中有酚羟基,能与浓溴水反应使溴水褪色,所以可以用浓溴水区别乙酰水杨酸和对乙酰氨基酚,
故答案为:可行;
(4)乙酰水杨酸与足量氢氧化钠溶液反应,羧基被中和,酯基水解生成酚钠和羧钠,反应方程式为
故答案为:
(5)乙酰水杨酸制备 ,可将先碱性水解得
,可将先碱性水解得 ,所用试剂为NaOH,
,所用试剂为NaOH, 再酸化可得
再酸化可得 ,所用试剂为HCl或H2SO4,
,所用试剂为HCl或H2SO4,
故答案为:NaOH;HCl或H2SO4.
点评 本题考查有机物推断,注意充分利用有机物结构官能团的性质进行答题,注意反应条件的应用,需要学生熟练掌握官能团的性质,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯水加入有色布条后,有色布条褪色,说明氯水中有HClO分子存在 | |
| B. | 制取漂白液的离子方程式是:Cl2+2OH-═Cl-+ClO-+H2O,该反应的氧化剂与还原剂的物质的量之比为1:1 | |
| C. | 1mol Cl2与足量Fe反应,转移的电子的物质的量为3 mol | |
| D. | 向某铁盐溶液中滴入KSCN溶液,无明显现象,加入氯水,溶液显血红色,说明原溶液中含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数是53 | B. | 质子数是125 | C. | 中子数是125 | D. | 电子数是53 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1 FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- | |
| B. | c(H+)=1×10-13mol•L-1的溶液中:Na+、Cu2+、SO42-、NO3- | |
| C. | 0.1mol•L-1NaHCO3的溶液中:NH4+、Na+、NO3-、Cl- | |
| D. | pH=1的溶液中:Na+、K+、NO3-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2隔绝空气密闭保存 | B. | 金属钾保存在煤油中 | ||
| C. | 白磷浸在煤油中 | D. | NaOH溶液用橡胶塞的试剂瓶装 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com