


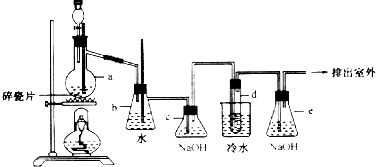
分析 (一)A.氨的造气用天燃气或煤,必产生二氧化碳;
B.电镀液含重金属离子,应处理后排放;
C.电解熔融氧化铝制金属铝的阳极上产生的是氧气,作为阳极材料的无烟煤会被氧化成二氧化碳,煤会消耗;
D.煤的气化后作了脱硫处理,污染减少;
(二)(1)煅烧中得到等物质的量的CO和CO2,S元素被还原得到Na2S;
(2)热水促进硫化钠水解,用碱液抑制硫化钠水解;
(3)硫化钠实际用量与理论用量比值x越小、汞除去率越高,最佳效果;
(4)根据Cu(OH)2溶度积可求得c(Cu2+),代入CuS的溶度积求得c(S2-);
(5)Cu由+2价变为+1价,得电子,所以阴极反应式为:2Cu2++2e-+H2O=Cu2O↓+2H+.
解答 解:(一)A.合成氨反应为N2+3H2?2NH3,所用的原料气是氮气、氢气,氮气来自空气,氢气来自水和碳氢化合物的反应,常用天燃气或煤,会产生废气二氧化碳,故A正确;
B.酸性废液用碱中和后,溶液呈中性,但电镀液含重金属离子,应处理后排放,故B错误;
C.电解熔融氧化铝制金属铝的阳极上产生的是氧气,作为阳极材料的无烟煤会被氧化成二氧化碳,煤会消耗,故C错误;
D.煤的燃烧能够产生二氧化硫,导致产生酸雨,煤通过液化气化,提高了燃烧效率,降低了污染,故D正确,
故选:AD;
(二)(1)煅烧中得到等物质的量的CO和CO2,S元素被还原得到Na2S,反应方程式为:3Na2SO4+8C$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S+4CO2↑+4CO↑,
故答案为:3Na2SO4+8C$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S+4CO2↑+4CO↑;
(2)Na2S是强碱弱酸盐,水解后溶液显碱性,加热会促进S2-水解,而加碱则可以抑制其水解,
故答案为:热水能促进Na2S水解,而稀碱可抑制Na2S水解;
(3)硫化钠实际用量与理论用量比值x越小、汞除去率越高,最佳效果,由图象可知当pH介于9~10时,x=12时汞的除去率最大,
故答案为:pH介于9~10之间,x=12;
(4)溶液pH=4,则溶液中c(OH-)=10-10 mol/L,根据Cu(OH)2溶度积可得c(Cu2+)=$\frac{2.2×1{0}^{-20}}{(1{0}^{-10})^{2}}$mol/L=2.2 mol/L,代入CuS的溶度积可得c(S2-)=$\frac{8.8×1{0}^{-36}}{2.2}$mol/L=4.0×10-36 mol/L,
故答案为:4.0×10-36 mol/L;
(5)Cu由+2价变为+1价,得电子,所以在阴极反应:2Cu2++2e-+H2O=Cu2O↓+2H+,有H+生成,所以溶液的pH降低,
故答案为:降低;2Cu2++2e-+H2O=Cu2O↓+2H+.
点评 本题是对化学与技术的考查,涉及常见化学工业、对操作的分析评价、对条件的控制、溶度积计算、电解原理等,侧重考查学生理论联系实际的能力、阅读获取信息的能力、知识迁移应用,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯与溴水混合后因发生反应而使溴水褪色 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡后静置,下层液体未褪色 | |
| C. | 1mol苯能与3mol H2发生加成反应,说明在苯环中含有3个双键 | |
| D. | 用冰冷却苯,苯可以凝结成无色的晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
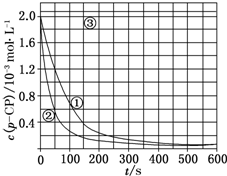 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 3 | |||
| ③ | 298 | 10 | 6.0 | 0.30 | |
查看答案和解析>>
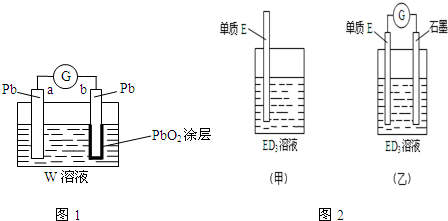
科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
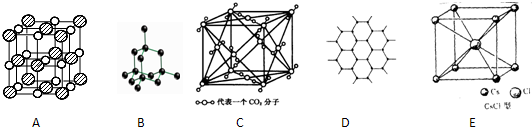
| A. | 晶体中只要有阳离子就一定有阴离子 | |
| B. | 氢键属于分子间作用力,不存在于分子内 | |
| C. | 原子晶体的熔点一定比金属晶体的高 | |
| D. | 构成分子晶体的微粒不一定含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com