
 摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
摩尔盐[(NH4)2SO4?FeSO4?6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用如图所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:| 0.01L×0.1000mol/L×10×5 |
| 1 |
| 19.6g |
| 24.50g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省高三上学期期末考试理综化学试卷(解析版) 题型:实验题
二氧化氯(ClO2)是一种广谱、高效的杀菌消毒剂,有与氯气相似的强烈刺激性气味,易溶于水,沸点11℃,遇热不稳定易分解发生爆炸。一种工业制法用硫铁矿(主要成分为FeS2)还原氯酸钠制取二氧化氯,某研究小组在实验室设计如下装置制备ClO2的水溶液。
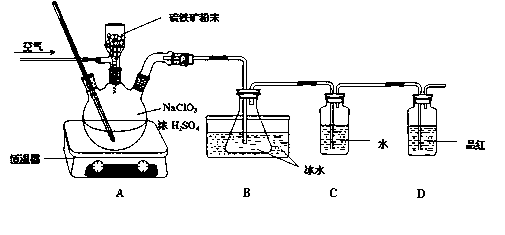
(1)三颈烧瓶中加入NaClO3溶液、浓H2SO4,通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速加入硫铁矿粉末。反应开始时烧瓶内发生反应的离子方程式如下,请配平该方程式:□ClO3- +□FeS2+□H+=□ClO2+□Fe3++□SO42-+□H2O
(2)装置D的作用是 。
(3)用上述反应完后的废液(除上述产物外,还有Al3+、Mg2+、H+、Cl-等)可制备摩尔盐,即(NH4)2Fe(SO4)2·6H2O。其操作流程如下:
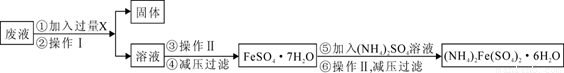
回答下列问题:
①操作Ⅰ的名称为: 。
②试剂X是 ,写出发生的主要反应的离子方程式 。
③为测定(NH4)2Fe(SO4)2·6H2O晶体中铁的含量,某实验小组做了如下实验:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.01000mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4_被还原成Mn2+。测得消耗KMnO4溶液的平均体积为21.00mL。则该晶体中铁的质量分数为 。(保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏州市高三调研测试化学试卷(解析版) 题型:计算题
摩尔盐[xFeSO4·y(NH4)2SO4·zH2O]是一种重要化工原料。其组成可通过下列实验测定:
①称取1.5680 g 样品,准确配成100 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒重,得到白色固体0.4660 g。
③再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0200 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1. 0×10-5mol·L-1,应保持溶液中c(Ba2+)
≥ mol·L-1。
(2)③中发生反应的离子方程式为 ,滴定终点的现象是 。
(3)通过计算确定样品的组成(必须写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
硫酸亚铁铵的制备
1、硫酸亚铁铵晶体的性质
物理性质:浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小
化学性质:能水解;具有还原性,但比硫酸亚铁稳定
2、将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体。
(NH4)2SO4+FeSO4+ 6H2O= (NH4)2SO4•FeSO4•6H2O↓根据下图回答:

(1)步骤1Na2CO3的主要作用是 。
(2)步骤2中铁屑过量的目的是(用离子方程式表示):
(3)步骤3中,加入(NH4)2SO4固体后,要得到摩尔盐晶体,需经过的实验操作包括:加热蒸发、 、 。
(4)步骤3中制得的晶体过滤后用无水乙醇洗涤的目的是 。
操作对比:
1、三个步骤中都含有加热的操作:
步骤1中:小火加热的目的是:
;
步骤2中:水浴加热的优点是 ;
水浴加热是为了 ;
步骤3中:加热是为了蒸发溶剂,浓缩结晶。
思考:该实验中,要得到摩尔盐晶体,应加热到 时,停止加热。
为什么不能蒸干?
那么蒸发下列溶液呢?
①从CuSO4溶液得到胆矾晶体: 。
②从NaCl溶液得到NaCl固体:
2、三个步骤中都含有固液分离的操作:
步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有:
A、沉淀的颗粒较大 B、沉淀容易沉降
C、沉淀呈胶状 D、沉淀呈絮状
步骤2中溶液趁热过滤的原因是 。
步骤3中可以用如下装置进行过滤:
(1)这种过滤方式称为:
(2)这种过滤跟普通过滤相比,除了过滤速度快外,
还有一个优点是: 。
(3)你能讲出仪器A、B、C的名称么?
查看答案和解析>>
科目:高中化学 来源: 题型:

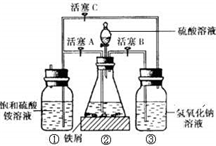
实验步骤:
(1)把30% NaOH溶液和废铁屑混合、煮沸、冷却,用清水洗净废铁屑。将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
试回答下列问题:
(1)F中的NaOH溶液的主要作用是____________________________________________。
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞______________,并同时打开活塞______________。
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用____________________________。
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液,再自然冷却结晶;②不蒸发溶液,直接自然冷却结晶。你认为较好的方法是______________。(填序号)
(4)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
_______________________________________、______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com