
| A. | 金属原子的核外电子在金属晶体中都是自由电子 | |
| B. | 镁型和铜型的原子堆积方式空间利用率最高 | |
| C. | 金属原子在化学变化中失去的电子数越多,其还原性越强 | |
| D. | 温度升高,金属的导电性将变大 |
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ④⑥⑧ | C. | ①②④⑤ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
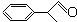 )曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题:
)曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题: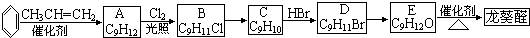
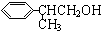 +O2
+O2
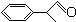 +2H2O.
+2H2O. 、
、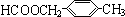 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
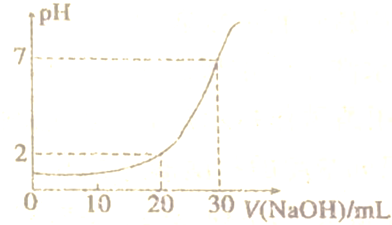
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电池工作时,正极反应式为:O2+2 H2O+4e-=4OH- | |
| B. | 电解时,a 电极周围首先放电的是Cl- | |
| C. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 忽略能量损耗,当电池中消耗0.2g H2时,b极周围会产生2.24LH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 在密闭容器中加入1.5 mol H2和0.5 molN2,充分反应后可得到NH3分子数为NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| D. | 标准状况下,22.4 L的CCl4中C-Cl键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的能量不一定高于M的能量 | |
| B. | X和Y的总能量一定低于M和N的总能量 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | 此反应符合质量守恒,却不符合能量守恒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com