
【题目】根据下图所给信息,得出的结论正确的是( ) 
A.碳的燃烧热为b kJ/mol
B.2C(s)+O2(g)═2CO(g)△H=﹣2(b﹣a) kJ/mol
C.2CO2(s)═2CO(g)+O2(g)△H=+a kJ/mol
D.C(s)+O2(g)═CO2(g)△H<﹣b kJ/mol
【答案】B
【解析】解:A、1molC完全燃烧生成二氧化碳固体放热bKJ,碳的燃烧热应该是1mol碳单质完全燃烧生成二氧化碳气体放出的热量,不是b kJ/mol,故A错误;
B、据图示可知,1molC燃烧生成CO放热b﹣aKJ,所以2molC燃烧生成CO放热2(b﹣a),故B正确;
C、1molCO燃烧生成1mol二氧化碳放热aKJ,所以2CO2(g)═2CO(g)+O2(g)△H=+2ak/mol,故C错误;
D、生成二氧化碳固体,△H=﹣b kJ/mol,但是固体转化为气体吸热,所以△H>﹣b kJ/mol,故D错误;
故选B.
【考点精析】通过灵活运用反应热和焓变,掌握在化学反应中放出或吸收的热量,通常叫反应热即可以解答此题.


科目:高中化学 来源: 题型:
【题目】用下面两种方法均可制得Fe(OH)2白色沉淀.
(1)方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备.①用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入 .
②除去蒸馏水中溶解的O2常采用的方法.
③制取Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是:防止发生反应 . (填化学方程式)
(2)方法二:在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.
①在试管Ⅰ里加入的试剂是 .
②为了制得Fe(OH)2白色沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=。
(2)若将lmol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。
①曲线I、Ⅱ对应的平衡常数大小关系为KIKⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为 , 该温度下的平衡常数为;若容器容积不变,下列措施可增加甲醇产率的是。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是 , 阳极电极反应为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的恒温恒容容器中,当下列物理量不再发生变化时,反应:A(g)+3B(g)2C(g)+D(g)不能表明已达平衡状态的是( )
A.混合气体的压强
B.混合气体的密度
C.B的物质的量浓度
D.气体总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是最常见的一次电池,它的总反应如下:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH由此可知,该电池放电时的负极材料是( )
A.Zn
B.Zn(OH)2
C.MnO2
D.MnOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所给信息,得出的结论正确的是( ) 
A.碳的燃烧热为b kJ/mol
B.2C(s)+O2(g)═2CO(g)△H=﹣2(b﹣a) kJ/mol
C.2CO2(s)═2CO(g)+O2(g)△H=+a kJ/mol
D.C(s)+O2(g)═CO2(g)△H<﹣b kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是一种可用于净水和膨化食品的盐,由A,B,C,D,E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D,E同主族.某同学为探究甲的组成而进行如下实验:
①取mg甲的晶体溶于蒸馏水,配成500mL溶液;
②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀的物质的量与滴入Ba(OH)2溶液体积的关系如图所示;
③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,然后折算成标准状况下的体积为224mL.
回答下列问题:
(1)D在元素周期表中的位置为 .
(2)经测定晶体甲的摩尔质量为453gmol﹣1 , 其中阳离子和阴离子物质的量之比为1:1. 则晶体甲的化学式为 .
(3)图象中V(Oa):V(ab):V(bc)= 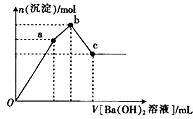
(4)写出ab段发生反应的离子方程式: .
(5)配成的甲溶液物质的量浓度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁涉及到的化学反应有:①CaO+H2O=Ca(OH)2、②Mg2++2OH﹣=Mg(OH)2↓、③Mg(OH)2+2HCl=MgCl2+2H2O、④MgCl2 ![]() Mg+Cl2↑没有涉及到的反应类型是( )
Mg+Cl2↑没有涉及到的反应类型是( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com