
【题目】填空
(1)磁性氧化铁的化学式________ ;写出铁与水蒸气反应的化学方程式_____________
(2)过氧化钠是___色固体;可用于 ________;其中氧元素的化合价___________
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( ) 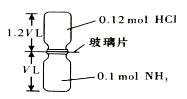
A.反应后瓶内压强是反应前的 ![]()
B.装置中氢元素的总质量为0.42 g
C.生成物的分子数目为0.1 NA
D.反应结束后,两个集气瓶很容易分开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量的铝投入过量的氢氧化钠溶液中充分反应,下列有关所得混合溶液的叙述正确的是( ) 
A.该溶液中,Ag+、K+、NH4+、SO42﹣可以大量共存
B.该溶液中,Na+、OH﹣、NO3﹣、CO32﹣不能大量共存
C.向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图
D.向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属性质的叙述正确的是( )
A. 钠与氧气反应时,产物是由氧气的用量决定的
B. 铝箔在空气中受热可以熔化且会发生剧烈燃烧
C. 金属与非金属发生反应时,被氧化的一定是金属
D. 铁丝不论在空气中还是中纯氧气中都不会燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图曲线①表示某种酶在各种温度下酶活性相对最高酶活性的百分比;曲线②是将该种酶在不同温度下保温足够长的时间,再在酶活性最高的温度下测其残余酶活性,由此得到酶的热稳定性数据。请回答下列问题:

(1)固定化酶的常用方法有________________。
(2)曲线②中,35℃和90℃的数据点是在______________℃时测得的。
(3)该种酶固定化后运用于生产,最佳温度范围是_______________,原因是______________。
(4)研究发现有甲、乙两种物质能降低该种酶的催化效率。已知该酶催化的底物浓度变化会改变甲物质对酶的影响,而不会改变乙物质对酶的影响。下图一是降低酶活性的两种机制模型;图二曲线是在酶的活性不受抑制时,起始反应速率与底物浓度的关系。

①符合甲、乙物质对酶影响的模型分别是______________、_______________。
②请在答题卡的指定位置画出加入甲物质时,起始反应速率与底物浓度之间的关系曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS.某同学用15.0g该废催化剂为原料,回收其中的锌和铜.采用的实验方案如下: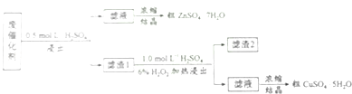
回答下列问题:
(1)在下列装置中,第一次浸出必须用 , 第二次浸出应选用 . (填标号)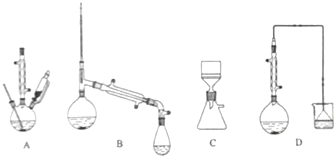
(2)第二次浸出时,向盛有滤液1的反应器中加入稀硫酸,后滴入过氧化氢溶液.若顺序相反,会造成 . 滤渣2的主要成分是 .
(3)浓缩硫酸锌、硫酸铜溶液使用的器皿名称是 .
(4)某同学在实验完成之后,得到1.5gCuSO4﹒5H2O,则铜的回收率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
A.1 g H2含有的氢原子数目为2NA
B.常温常压下,22.4 L O2含有的分子数目为NA
C.1 L 1 molL﹣1 KOH溶液中含有的钾离子数目为NA
D.1 mol Zn变为Zn2+失去的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】14g Cu、Ag合金与一定量某浓度的硝酸溶液完全反应,将放出的气体与1.12L(标准状况)O2混合通入水中,恰好被水完全吸收,则合金中Cu的质量为( )
A.9.6g
B.6.4g
C.3.2g
D.4.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在使用分液漏斗进行分液时,正确的操作是( )
A. 上层液体经漏斗下口放出
B. 分离液体时,将漏斗拿在手上进行分离
C. 分离液体时,使分液漏斗口上的小孔与大气相通,打开活塞
D. 分液漏斗中盛装的是液体,振荡后不必扭开活塞把气体放出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com