
【题目】下列互为同位素的是( )
A. H2D2 B. 14N14C C. 16O17O D. 金刚石石墨
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
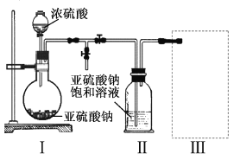
实验一焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:
Na2SO3+SO2=Na2S2O5
(1)装置I中产生气体的化学方程式为 。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是 。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 。(填序号)。
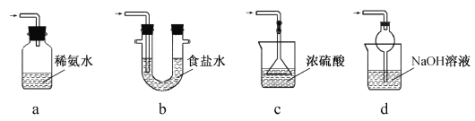
实验二焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是 。
实验三葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:馏分中的二氧化硫在滴入碘水时发生的反应为
SO2+I2+2H2O=H2SO4+2HI)在测定时消耗了0.01mol·L-1的I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等。
(1)以N2 和H2 为原料合成氢气为: N2(g) + 3 H2(g) ![]() 2NH3(g) △H=Q kJmol—1。已知键键能为946 kJmol—1 ,H-H键键能为436kJ mol—1,N-H键键能为391kJ mol—1,则Q=_______。
2NH3(g) △H=Q kJmol—1。已知键键能为946 kJmol—1 ,H-H键键能为436kJ mol—1,N-H键键能为391kJ mol—1,则Q=_______。
(2)将体积均为560 mL(标准状况下)的SO2 和Cl2 同时缓慢通A水中,得到1.0 L溶液,则溶液pH=_______。
(3)物质的量浓度相等的NH4HSO3溶液和NaHSO3 溶液中,阴离子的电离程度较小的是__________(填化学式),原因是___________ 。
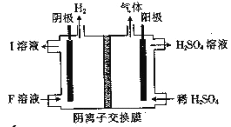
(4)用惰性电极电解NaHSO3 溶液的装置如图所示,则I是___________(填化学式,下同),阳极区放出的混合气体的成分为___________。
(5)氨水是一种常见的沉淀剂。向1.0 L 2.0×10—4molL—1的MgCl2 溶液中通入(不考虑溶液体积的变化),有白色沉淀生成。
①写出生成白色沉淀的离子方程式____________________.
②当反应中开始有白色沉淀出现时,通人的体积(标准状况)为___________mL。
(已知实验条件下NH3.H2O的电离平衡常数为1.8×l0—5,Ksp=[Mg(OH)2]=1.8×l0—11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)A中固体试剂是 ;B中所盛溶液溶质是 ;C中所盛溶液溶质是 (填字母)
a.醋酸钠 b.碳酸氢钠 c.苯酚钠 d.碳酸钠
(2)写出C中反应的离子方程式是: ;
(3)有同学认为没有B装置,也可以验证酸性的强弱,你认为这种说法合理吗?说出你的理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,也是造成水体富营养化及氮氧化物污染的重要因素之一。
(1)N2和H2以物质的量之比为1∶3在不同温度和压强下发生反应:N2+3H2![]() 2NH3,测得平衡体系中NH3的物质的量分数如图1。
2NH3,测得平衡体系中NH3的物质的量分数如图1。
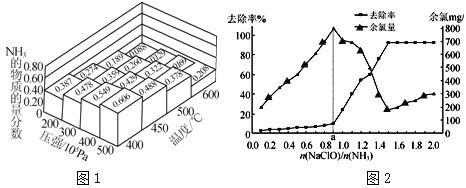
①为提高原料气的转化率,工业上采取的合理措施有 (填字母)。
a. 采用常温条件
b. 使用适当的催化剂
c. 将原料气加压
d. 将氨液化并不断移出
②图1中所示的平衡体系中NH3的物质的量分数为0.549和0.488时,该反应的平衡常数分别为K1、K2,则K1 K2。(填“>”“<”或“=”)
(2)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,涉及的相关反应如下:
反应①:NH3+HClO===NH2Cl+H2O
反应②:NH2Cl+HClO===NHCl2+H2O
反应③:2NHCl2+H2O===N2+HClO+3HCl
已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件一定的情况下,改变![]() (即NaClO溶液的投入量),溶液中次氯酸钠对氨氮去除率及余氯量 (溶液中+1价氯元素的含量)的影响如图2所示。
(即NaClO溶液的投入量),溶液中次氯酸钠对氨氮去除率及余氯量 (溶液中+1价氯元素的含量)的影响如图2所示。
①反应中氨氮去除效果最佳的n(NaClO)/n(NH3)值约为 。
②a点之前氨氮去除率较低的原因为 。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图3。
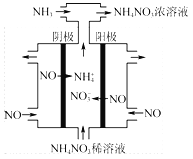
①电解过程(虚线内)发生反应的离子方程式为 。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学与技术]
海水占地球总储水量的97.2﹪。若把海水淡化和化工生产结合起来,既能解决淡水资源缺乏的问题,又能充分利用海洋资源。
下图是利用海水资源进行化工生产的部分工艺流程示意图:

(1)该工艺流程示意图中包含了 、 (填化学工业的名称)。
(2)在流程Ⅰ中,欲除去粗盐中含有的Ca2+、Mg2+、SO42+等离子,需将粗盐溶解后,按顺序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 (填字母)。
A.Na2CO3、NaOH、 BaCl2、过滤、盐酸
B.NaOH、 BaCl2、 Na2CO3、过滤、盐酸
C.NaOH、 Na2CO3、 BaCl2、过滤、盐酸
D.BaCl2、Na2CO3、 NaOH、 过滤、盐酸
(3)流程Ⅱ中,通电开始后,阳极区产生的气体是 (填化学式),阴极附近溶液pH会 (填“增大”、“减小”或“不变”)。
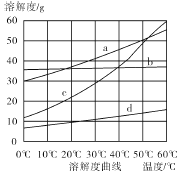
(4)流程Ⅲ中,通过相应化学反应可以得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,生成NaHCO3晶体的化学反应方程式是 。
(5)流程Ⅳ中,所得纯碱常含有少量可溶性杂质,常用的提纯方法是 (填名称),通过该法提纯后得到纯净的Na2CO3·10H2O,Na2CO3·10H2O脱水得到无水碳酸钠。
已知:Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
把脱水过程产生的气态水完全液化释放的热能全部用于生产Na2CO3所需的能耗(不考虑能量损失),若生产1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)= H2O(l) △H= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com