
| A.G→a→e→b→f→d→c |
| B.G→c→d→b→e→f→a |
| C.G→a→e→f→b→d→c |
| D.G→b→e→f→a→d→c |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
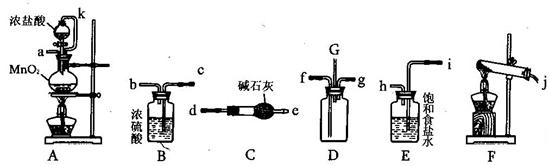
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
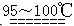 S2Cl2。
S2Cl2。| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
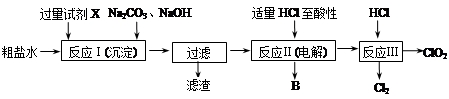
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
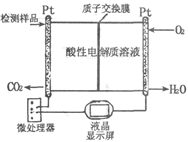
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3、NO的体积比保持不变 | D.每消耗 1 mol SO2,同时生成1 mol NO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
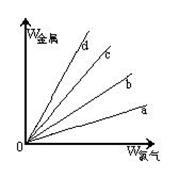
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2中混有少量HCl:通过盛有硝酸银溶液的洗气瓶 |
| B.Cl2中混有少量水蒸气:通过足量浓硫酸,收集气体 |
| C.Cl2中混有少量HCl:通过碱石灰后收集气体 |
| D.HCl中混有少量Cl2:通入氢气光照 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.液溴易挥发,在存放液溴的试剂瓶中应加水封 |
| B.能使湿润的淀粉KI试纸变蓝色的物质一定是Cl2 |
| C.某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I- |
| D.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com