
| A. | 酸性:HClO4>H2SO4>H3PO4 | B. | 沸点:H2O<H2S<H2Se | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 熔点:金刚石>NaCl>冰 |
分析 A.非金属性越强,最高价氧化物的水化物的酸性越强;
B.结构相似的分子晶体,相对分子质量越大,沸点越大,含有氢键的沸点较高;
C.金属性越强,最高价氧化物的水化物的碱性越强;
D.熔点为原子晶体>离子晶体>分子晶体.
解答 解:A.非金属性Cl>S>P,则最高价氧化物的水化物的酸性为HClO4>H2SO4>H3PO4,故A正确;
B.结构相似的分子晶体,相对分子质量越大,沸点越大,含有氢键的沸点较高,则沸点为H2S<H2Se<H2O,故B错误;
C.金属性Na>Mg>Al,则最高价氧化物的水化物的碱性为NaOH>Mg(OH)2>Al(OH)3,故C正确;
D.熔点为原子晶体>离子晶体>分子晶体,则熔点为SiO2(原子晶体)>NaCl(离子晶体)>SiI4(分子晶体),故D正确;
故选B.
点评 本题考查熔沸点的比较、非金属和金属性的比较,明确常见的比较的方法是解答本题的关键,注意知识的归纳整理,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Ba2+、Cl-、SO42- | B. | Ca2+、HCO3-、Cl-、K+ | ||
| C. | Mg2+、Ag+、NO3-、Cl- | D. | H+、Cl-、Na+、CO32- | ||
| E. | SO32-、Ba2+,H+,NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
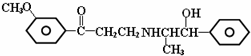
| A. | 可以发生加成反应 | B. | 可以发生消去反应 | ||
| C. | 可以发生银镜反应 | D. | 可以发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油燃烧 | |
| B. | 木材燃烧 | |
| C. | 在汽化炉内加热固体生物质,同时通入空气或水蒸气,或者隔绝空气高温加热生物质,使之发生复杂的化学反应产生可燃气体 | |
| D. | 杂草和人畜粪便加入沼气发酵池中生成沼气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
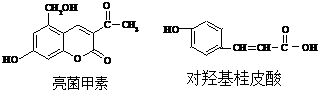
| A. | 将各1mol的两种物质分别与氢氧化钠溶液充分反应,消耗等量氢氧化钠 | |
| B. | 将各1mol的两种物质分别与溴水充分反应,消耗等量溴分子 | |
| C. | 将各1mol的两种物质分别与氢气充分反应,消耗等量氢气 | |
| D. | 两种有机物中的所有原子均不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3经催化氧化生成NO | B. | NO与O2反应生成NO2 | ||
| C. | N2与H2在一定条件下反应生成NH3 | D. | 由NH3制碳酸氢铵和硫酸铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 | 8960mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com