
【题目】氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO![]() 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
时间(s) | 0 | 2 | 4 |
c(NO) ( mol·L-1) | 1.00×10-3 | 2.50×10-4 | 1.00×10-4 |
c(CO) ( mol·L-1) | 3.60×10-3 | c’ | 2.70×10-3 |
回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前4s内的平均反应速率v(NO)= 。c’= 。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。右图表示在其他条件不变时,上述反应中二氧化碳浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
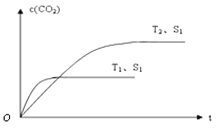
①该反应的ΔH 0(填“>”、“<”或“=”)。
②若催化剂的表面积S1>S2,在答题卡图中画出c(CO2) 在T2、S2条件下达到平衡过程中的变化曲线。
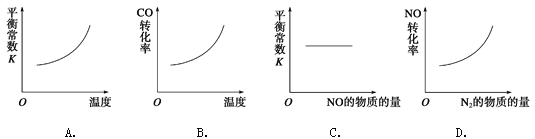
(3)在恒容的密闭容器中,上述反应达到平衡后,改变某一条件,下列示意图正确的是
【答案】(1)2.25×10-4mol/(L·s) 2.85×10-3 mol/L (各2分,共4分)
(2)① < (2分)
②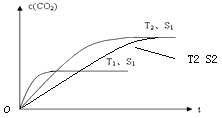 (3分,①曲线画错不得分:注意起始点、变化趋势、拐点;②曲线正确但不标条件扣1分) (3) C (3分)
(3分,①曲线画错不得分:注意起始点、变化趋势、拐点;②曲线正确但不标条件扣1分) (3) C (3分)
【解析】
(1)根据v(NO)=c/t进行计算;根据反应方程式进行相关计算;
(2)①根据图像可知,在固体催化剂的表面积不变的情况下,温度为T1的曲线首先达到平衡状态。温度高反应速率快,到达平衡的时间少;温度高平衡时CO2的浓度降低,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应;
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率,但催化剂不能改变平衡状态;
(3)根据影响平衡移动移动规律、平衡常数的规律进行分析。
(1)根据表中数据可知,前4s内NO的浓度变化量=1.00×10-3mol/L-1.00×10-4mol/L=9.00×10-4mol/L,所以NO的平均反应速率v(NO)=![]() =2.25×10-4mol/(L·s)。前2s内NO浓度减少了1.00×10-3mol/L-2.50×10-4mol/L=7.50×10-4mol/L。根据方程式可知,消耗CO的浓度=7.50×10-4mol/L,所以此时CO的浓度=3.60×10-3mol/L-7.50×10-4mol/L=2.85×10-3 mol/L。
=2.25×10-4mol/(L·s)。前2s内NO浓度减少了1.00×10-3mol/L-2.50×10-4mol/L=7.50×10-4mol/L。根据方程式可知,消耗CO的浓度=7.50×10-4mol/L,所以此时CO的浓度=3.60×10-3mol/L-7.50×10-4mol/L=2.85×10-3 mol/L。
(2)①根据图像可知,在固体催化剂的表面积不变的情况下,温度为T1的曲线首先达到平衡状态。温度高反应速率快,到达平衡的时间少。因此温度是T1>T2。但温度高平衡时CO2的浓度降低,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应,即△H<0。
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率,但催化剂不能改变平衡状态。所以若催化剂的表面积S1>S2,则在温度为T2时,达到平衡的时间增加,但平衡状态不变,因此图像为
 。
。
(3)A、正方应是放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,A不正确;B、正方应是放热反应,升高温度平衡向逆反应方向移动,CO的转化率降低,B不正确;C、平衡常数只与温度有关,增大NO的浓度,平衡向正反应方向移动,但平衡常数不变,C正确;D、增大生物物氮气的浓度,平衡向逆反应方向移动,NO的转化率降低,D不正确,答案选C。


科目:高中化学 来源: 题型:
【题目】下列反应中,Na2O2只表现强氧化性的是
A. 2Na2O2 + 2CO22Na2CO3 + O2
B. Na2O2 + MnO2 =Na2MnO4
C. 5Na2O2 + 2MnO![]() + 16H+ = 10Na+ + 2Mn2+ + 5O2↑ + 8H2O
+ 16H+ = 10Na+ + 2Mn2+ + 5O2↑ + 8H2O
D. 2Na2O2 + 2H2SO4 = 2Na2SO4 +2H2O + O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系:

(1)若X单质的一种同素异形体是一种黑色的非金属单质,则Y转化为Z的化学方程式_________________,Z的晶体类型______________晶体。
(2)若X为一种金属的氯化物,Y是一种常见的两性氢氧化物,W为化工常用的强碱,写出Y与W反应的离子方程式_______________________。
(3)若X是一种活泼的金属单质,Z是一种淡黄色的化合物,Z的化学式___________,则Z转化为W的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(Ⅵ)是主要污染物,可采用多种处理方法将其除去。查阅资料可知:
①在酸性环境下,Cr(Ⅵ)通常以Cr2O72-的形式存在;
②Cr2O72-的氧化能力强于CrO42-;
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
阳离子 | Fe3+ | Fe2+ | Cr3+ |
开始沉淀的pH | 1.9 | 7.0 | 4.3 |
沉淀完全的pH | 3.2 | 9.0 | 5.6 |
Ⅰ.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(Ⅵ)。下列关于焦炭的说法正确的是_______(填字母代号)。
a.作原电池的正极 b.在反应中作还原剂 c.表面可能有气泡产生
Ⅱ.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。电解装置如图1所示。
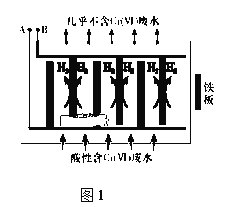
(2)A极连接电源的______________极,A极上发生的电极反应式为_______________
(3)电解开始时,B极上除了发生产生H2的反应外,还有少量Cr2O72-在B极上直接放电,该反应的电极反应式为_________________
(4)电解过程中,溶液的pH不同时,通电时间(t)与溶液中铬元素去除率的关系如图2所示。
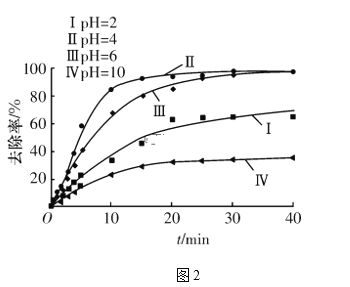
①由图可知,电解还原法应采取的最佳pH范围为____(填字母代号)。
a.2~4 b.4~6 c.6~10
②解释曲线Ⅰ和曲线Ⅳ去除率低的原因:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将1.0Lcmol/LCH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入CH3COOH 或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是

A. 该温度下,醋酸的电离平衡常数Ka=![]()
B. a点对应的混合溶液中c(CH3COOH)>c(Na+)>c(OH-)
C. 水的电离程度:c>b>a
D. 当混合溶液呈中性时,c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种常见的非金属元素A与B,与常见的三种金属元素C、D、E,A的一种单质是自然界硬度最大的物质,B与C的单质在加热条件下反应生成淡黄色化合物X,D的单质既能与盐酸,也能与NaOH溶液反应生成![]() ,E的单质在B的单质中燃烧火星四溅,生成一种黑色固体Y。请回答下列问题:
,E的单质在B的单质中燃烧火星四溅,生成一种黑色固体Y。请回答下列问题:
![]() 物质X的名称______。
物质X的名称______。
![]() 将D的单质用砂纸打磨,然后灼烧,液态的D并不滴落的原因______。
将D的单质用砂纸打磨,然后灼烧,液态的D并不滴落的原因______。
![]() 写出E的单质与水蒸气反应的化学方程式______。
写出E的单质与水蒸气反应的化学方程式______。
![]() gC的单质投入足量
gC的单质投入足量![]() 溶液中,下列实验现象正确的有______。
溶液中,下列实验现象正确的有______。
A.钠沉在溶液底部
B.熔化成银色光亮的小球
C.小球四处游动发出”嘶嘶”的声音
D.生成红色固体物质
![]() 第
第![]() 中可能的离子方程式为______。将所得沉淀过滤、洗涤、干燥,可得到______g固体。
中可能的离子方程式为______。将所得沉淀过滤、洗涤、干燥,可得到______g固体。
![]() 在少量
在少量![]() 中燃烧,所得混合气体在标况下的平均摩尔质量为
中燃烧,所得混合气体在标况下的平均摩尔质量为![]() ,则A与
,则A与![]() 的物质的量之比为______。
的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是![]()
A.金属钠投入水中:![]()
B.往酸性碘化钾溶液中滴加适量的双氧水:![]()
C.往![]() 溶液中加过量的NaOH溶液并加热:
溶液中加过量的NaOH溶液并加热:![]()
![]()
![]()
D.氯气通入水中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和AlCl3溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
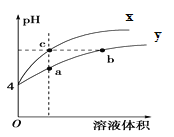
A.Al(OH)3的电离方程式为:Al(OH)3=Al3++3OH-
B.a点溶液中有: c(H+)+c(Al3+)=c(OH-) +3c(Cl-)
C.曲线X表示盐酸稀释过程的pH变化
D.b、c两溶液c(OH-)及c(Cl-)均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 在7.8gNa2O2固体中,含有阴、阳离子的总数为0.3NA
B. 光照下,将16gCH4和71gCl2组成的混合气体充分反应,生成CH3Cl分子数为NA
C. 若发生水解的Fe3+为1mol,此时生成的氢氧化铁胶粒数为NA
D. 100g质量分数为46%的乙醇水溶液中,所含氢原子总数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com