
【题目】化学与生活密切相关,下列说法错误的是( )
A.硅胶、生石灰、氯化钙等都是食品包装袋中常用的干燥剂
B.厕所清洁剂、食用醋、肥皂水、厨房清洁剂四种溶液的pH逐渐增大
C.酒精能使蛋白质变性,预防新冠肺炎病毒使用的酒精纯度越高越好
D.使用氯气对自来水消毒时,氯气会与自来水中的有机物反应,生成的有机氯化物可能对人有害
科目:高中化学 来源: 题型:
【题目】在三个密闭容器中分别充入Ne、H2、O2三种气体,在以下各种情况下排序正确的是( )
A.当它们的体积、温度和压强均相同时,三种气体的密度ρ(H2)>ρ(Ne)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强p(H2)>p(Ne)>p(O2)
C.当它们的质量、温度和压强均相同时,三种气体的体积V(O2)>V(Ne)>V(H2)
D.当它们的压强、体积和温度均相同时,三种气体的质量m(H2)>m(Ne)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是( )
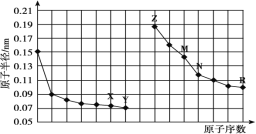
A.最高价氧化物对应水化物的碱性:Z<M
B.Y、R两种元素气态氢化物的稳定性:Y>R
C.X、N两种元素形成的化合物属于离子化合物
D.简单离子的半径:Z>M>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.8 kJ·mol–1。
CH3OH(g) ΔH=-90.8 kJ·mol–1。
(1)在容积为1 L的恒容容器中,分别研究在230℃、250℃和270 ℃三种温度下合成甲醇的规律。
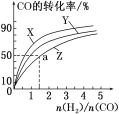
如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是_______。
Ⅱ.如图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。
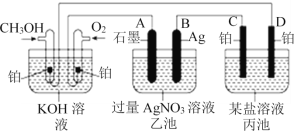
(2)乙池中A(石墨)电极的名称是______。
(3)通入CH3OH的电极的电极反应式为______。
(4)乙池中反应的化学方程式为_________
(5)当乙池中B(Ag)极的质量增加5.4 g时,甲池中理论上消耗O2 ________mL(标准状况),此时丙池某电极上析出1.60 g某金属,则丙池中的某盐溶液可能是________(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
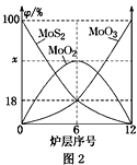
【题目】钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
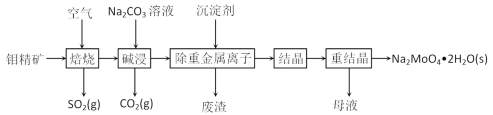
(1)提高焙烧效率的方法有:_____________(写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________。氧化产物是________________。
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为 ______________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20molL1,c(SO42-)=0.01molL1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________。〔已知Ksp(BaSO4)=1×1010,Ksp(BaMoO4)=2.0×108〕
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
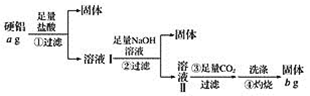
(1)溶液Ⅰ中的溶质为_________(填化学式,下同),溶液Ⅱ中的溶质为__________。
(2)上述第③步反应中,生成沉淀的离子方程式为____________。
(3)该合金中铝的含量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃主链上有4个碳原子的同分异构体有2种,含有相同碳原子数且主链上也有4个碳原子的单烯烃的同分异构体有( )
A. 2种 B. 4种
C. 5种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示的装置制取少量溴苯。

请回答下列问题:
(1)在烧瓶a中反应的化学方程式是__________________________________________。
(2)与烧瓶口垂直的一段长导管的作用是______________________________________。
(3)锥形瓶C中盛放四氯化碳的作用是________________________________________。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向锥形瓶C中加入硝酸银溶液,若________,则能证明。另一种验证的方法是向锥形瓶C中加入________________________,现象是________________________________________________________________________。
(5)生成的溴苯因溶有未反应的溴而显褐色,提纯的方法是____________________________。
(6)实验结束时,将氢氧化钠溶液倒入烧瓶中,充分振荡,目的是_________________________,反应的化学方程式是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。
(1)汽车内燃机工作时发生反应:N2(g)+O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
①5min内该反应的平均速率υ(NO)=___;在T℃时,该反应的平衡常数K=___。
②反应开始至达到平衡的过程中,容器中下列各项发生变化的是___(填序号)。
a.混合气体的密度
b.混合气体的压强
c.正反应速率
d.单位时间内,N2和NO的消耗量之比
(2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com