
CuSO4��5H2O��ͭ����Ҫ��������Ź㷺��Ӧ�á�ʵ�����ô�ͭ�������������Ʊ�CuSO4��5H2O���������£�
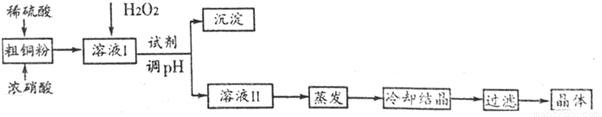
�ش��������⣺
��1��ʵ��������250 mL4.8 mol��L��1��ϡ���ᣬ����IJ�������������������Ͳ���ձ������Ҫ__________________________________________________��
��2����֪��ͬ����������������������������pH���±���
|
���� |
Fe3+ |
Cu2+ |
Fe2+ |
|
��ʼ������pH |
2.7 |
4.4 |
7.0 |
|
������ȫ��pH |
3.7 |
6.4 |
9.6 |
��ȥFe3+����Һ��pHӦ����_______________��Χ����pH��ѡ�õ��Լ���____________��
��3�����Ƶõ�CuSO4��5H2O�д�������Cu(NO3)2����һ���ᴿ��ʵ�����������__________��
��4����õ�CuSO4��5H2O������渽���������ӣ����þƾ�ϴ�ӵ�ԭ����____________��
�ñ���BaCl2��Һ�ⶨ����Ĵ���ʱ�����ִ��ȴ���100%���ⶨ�����в��������ɺ��ԣ��������ԭ����_____________________________________________����дһ�֣���
��5��ʵ��������ȡ����NO���塣��ͼ�����ʺϵ�ʵ��װ����__________������ţ�����ע��װ��������ҩƷ�����ơ�
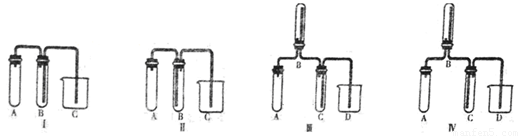
A��__________��B��__________��C��__________��D��__________��������ѡ���װ�ÿ�������Ҳ���Բ�������
��1��250mL����ƿ����ͷ�ι�
��2��3.7��pH��4.4 CuO��Cu(OH)2��Cu2(OH)2CO3
��3���ؽᾧ
��4����ȥ���ʣ����پ�����ܽ���ʧ
��5���� A��ϡ������ͭ��B��ˮ��C��ˮ
��������
���������������ͨ����ͭ������ȥ�������Ʊ�����ͭ�����ʵ�����̡���1������һ��Ũ�ȵ���Һ��Ҫר�õ�������������ƿ����Ҫע�������ʱ��Ҫ�õ���ͷ�ιܣ���2����������ΪFe2+���׳�ȥ����Ҫ����������Fe3+��Ȼ��ͨ������pH����Fe(OH)3��ȥ��pH��ΧӦ����Fe3+������ȫ��Cu2+�����ֳ�������Ӧ��3.7��pH��4.4������ѡ�õ��Լ�Ӧ�Dz�����ˮ�ġ����ܲ����������������ᷴӦ�ٽ�ˮ������ʣ���ѡ��CuO��Cu(OH)2��Cu2(OH)2CO3�ȣ���3����ȥ�����еĿ��������ʵķ������ؽᾧ����4��ϴ�ӵ����������dz�ȥ���ʣ�����һ�㲻�����л�������Ҵ����м��پ�����ܽ���ʧ�����ã�BaCl2��Һ�ⶨ����ⶨ���Ǿ�����SO42-������Ĵ��ȴ���100%˵��SO42-����ƫ�ߣ������Ǻ���������SO42-�ٷֺ�����������ͭ��������ʣ����п����Ǿ���ʧȥ���ֽᾧˮ����SO42-����ƫ�ߣ�
��5��ʵ��������ȡNO��������ϡ������ͭ��Ӧ��NOֻ������ˮ���ռ�����ѡ�â�Aʢ��ϡ������ͭ��Bʢ��ˮ�������ռ�NO��C���ų���ˮ��
���㣺����ʵ�����֪ʶ���漰ʵ��������ѡ��ʵ����������ݡ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �¶ȣ��棩 | 20 | 40 | 60 | 80 | 100 |
| ʯ�� | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| ���� | 32 | 44.6 | 61.8 | 83.8 | 114 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| OH- |
| H+ |
| OH- |
| H+ |
| ||
| ||
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ö����ЧӦ����Fe��OH��3�����FeCl3��Һ | B����Ʒ����Һ�����ֶ�����̼�Ͷ������� | C����CuSO4?5H2O����ƾ��к��е�ˮ | D����ɫ��ӦΪ��ɫ��ij��Һ��һ������Na+ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com