


科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)化合物A(C7H12),在酸性高锰酸钾溶液中加热回流,反应液中只有环己酮一种有机物,A与氯化氢反应得化合物B,B与乙醇钠-乙醇溶液共热生成化合物C,C能使溴的四氯化碳溶液褪色并生成化合物D,再将D与乙醇钠-乙醇溶液共热则得到化合物E,E与高锰酸钾溶液加热回流得丁二酸和丙酮酸。化合物C若经臭氧解(O3氧化,然后用H2O/Zn处理)则生成6氧代庚醛。
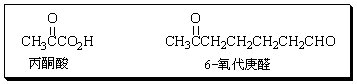
(1)写出化合物AE的结构式(不考虑化合物的立体异构)。
(2)用系统命名法命名化合物B,C,D,E
(3)上述化合物中哪个可以由乙烯和2甲基1,3丁二烯经一步反应而制得?请用反应式表示。
(4)如何将6氧代庚醛转化为1,6庚二醇?请用反应式表示。
查看答案和解析>>
科目:高中化学 来源:2013届四川省双流市棠中外语学校高三9月月考化学试卷(带解析) 题型:单选题
酸性高锰酸钾溶液能将醇氧化成一系列产物,反应中KMnO4被还原为Mn2+。用0.5mol·L-1的酸性高锰酸钾溶液滴定20.0mL0.25mol·L-1的乙二醇溶液,当用去20.0mL高锰酸钾溶液时,再加一滴高锰酸钾溶液恰好呈紫色,振荡后不褪色。则乙二醇被氧化为
| A.HOCH2-CHO | B.OHC-CHO | C.HOOC-CHO | D.CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com