
开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4—构成,BH4—呈正四面体构型。LiBH4中不存在的作用力有______(填标号)。
A.离子键 B.共价键 C.金属键 D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
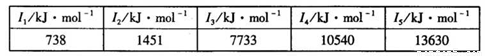
M是______(填元素符号)。
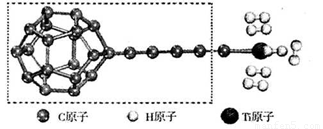
(3)某种新型储氢材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有______种。
(4)分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是______(填标号)。
A.H2O B.CH4 C.HF D.CO(NH2)2
(13分)
(1)①1(1分)
②C(2分)
③H>B>Li(2分)
(2)①<(2分)
②Mg(2分)
(3)3(2分)
(4)B、C(2分)
【解析】
试题分析:(1)、①钛是22号元素,基态钛原子电子排布式为1s22s22p63s23p63d24s2,Ti—3e—=Ti3+,则基态Ti3+的电子排布式为1s22s22p63s23p64s1,未成对电子数为1;②Li+和BH4—之间存在离子键,BH4—之间存在共价键和配位键,则硼氢化锂中不存在金属键;③LiBH4中LiH同主族,LiB同周期,由元素周期律可知,则锂元素的电负性最小,BH4—中硼显+3价,氢显—1价,说明氢的电负性比硼大,则H>B>Li;(2)、①Li+和H—具有K层2电子稳定结构,核电荷数:Li>H,则原子半径:Li+<H—;②根据M的部分电离能数据推断,M为容易失去2个电子的镁元素;(3)、观察可知,虚线框内碳原子杂化轨道类型有sp2杂化(五元环中的大多数碳原子)、sp3杂化(五元环中与侧链相连的碳原子)、sp(侧链中的碳原子)杂化三种类型;(4)、水分子中O—H键与相邻水分子中电负性较大的O之间可以形成氢键,且形成笼状结构;B、甲烷分子中碳元素的电负性较小,故不能形成氢键,也不能形成笼状结构;C、氟化氢分子中F—H键与相邻氟化氢分子中电负性较大的F之间能形成氢键,但是不能形成立体笼状结构,错误;D、尿素中电负性较大的O、N与相邻分子中的N—H键之间不仅可以形成氢键,而且可以形成笼状结构。
考点:考查基态原子或离子的电子排布式、化学键的类型、电负性和离子半径的大小、电离能、杂化轨道类型、氢键的形成、分子的立体结构等相关知识。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
 (2013?临沂三模)[化学--物质结构与性质]
(2013?临沂三模)[化学--物质结构与性质]| 52 |
| a.NA |
| 52 |
| a.NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| I1/kJ?mol-1 | I2/kJ?mol-1 |
I3/kJ?mol-1 |
I4/kJ?mol-1 |
I5/kJ?mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
查看答案和解析>>
科目:高中化学 来源:2013年山东省临沂市高考化学三模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com